
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы сильных электролитов
|
|
|
|
Вследствие полной диссоциации число ионов в растворе сильных электролитов всегда больше, чем в растворах слабых электролитов той же концентрации. В концентрированных растворах расстояние между ионами мало. Это приводит к сильному межионному действию. В результате около иона находятся ионы противоположного знака: образуются ионные пары, триплеты – т.е. образуются "ионные атмосферы".
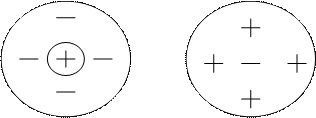
Поэтому в этом случае возникает эффект уменьшения числа ионов, участвующих в химических процессах.
В электрическом поле ионы разных знаков движутся к разным электродам, это приводит к уменьшению подвижности ионов. Чем выше концентрация, тем сильнее тормозящее действие ионной атмосферы. Кроме этого движение ионов тормозит и сольватная оболочка. При разбавлении растворов влияние "ионной атмосферы" уменьшается, а при бесконечном разведении исчезает.
Теория Дебая Хюккеля объясняет найденные опытным путем значения электрической проводимости, степени диссоциации, которые меньше чем следовало ожидать при 100% диссоциации.
В результате тормозящего действия "ионных атмосфер" определяемая по электрической проводимости растворов степень диссоциации является кажущейся степенью диссоциации. Эта величина с ростом концентрации уменьшается.
Можно считать, что в растворах электролитов во всех процессах участвуют лишь "активные ионы", т.е. ионы не принимающие участие в межионных взаимодействиях. В связи с этим для оценки концентрационных эффектов в растворах сильных электролитов вводится величина – активность (а).
 Под активностью электролита понимают эффективную концентрацию, в соответствии с которой он принимает участие в различных процессах.
Под активностью электролита понимают эффективную концентрацию, в соответствии с которой он принимает участие в различных процессах.
|
|
|
Активность связана с истинной концентрацией растворенного вещества
а (в-ва) = f в-ва * С в-ва
а – активность вещества (моль/л)
С – концентрация вещества (моль/л)
f – коэффициент активности (безмерная величина)
Этот коэффициент показывает отклонение раствора с данной концентрацией от поведения раствора при бесконечном разведении, т.е. при отсутствии межионных взаимодействий. Активность и коэффициент активности можно определить экспериментально.
На коэффициент активности влияет:
1. концентрация вещества
2. температура;
3. концентрация других ионов.
1) При переходе от разбавленных растворов к концентрированным коэффициент активности уменьшается из-за увеличения межионного взаимодействия. При концентрации близкой к значению 1 моль/л, коэффициент возрастает и может быть больше 1. Это объясняется тем, что в растворе не хватает воды для гидратации, что увеличивает подвижность ионов.
2) При повышении температуры, f увеличивается, т.к. возрастает подвижность ионов и происходит разрушение гидратного слоя.
3) На f влияет общая концентрация ионов в растворе.
Следует отметить, что в любых растворах эффективные концентрации не равны аналитическим, следовательно в любых случаях следует говорить не о концентрации, а об активности.
Активности разных ионов одного электролита не равны, поэтому для определения свойств раствора учитывают среднюю активность ионов
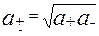
Это справедливо и для коэффициента активности
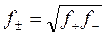
Эти понятия позволяют определить свойства реальных растворов.
Для оценки сил межионного взаимодействия, для предсказания свойств растворов электролитов пользуются законом Дебая – Хюккеля; который сформулирован следующим образом:
 В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны не зависимо от их химической природы.
В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны не зависимо от их химической природы.
|
|
|
Математическое выражение этого закона:
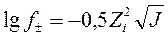
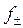 - коэффициент активности;
- коэффициент активности;
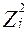 - заряд иона;
- заряд иона;
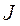 - ионная сила раствора.
- ионная сила раствора.
Ионная сила - это величина измеряемая полусуммой произведения концентрацией всех находившихся в растворе ионов на квадрат их зарядов.
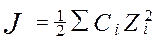
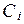 - концентрация;
- концентрация;
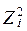 - заряд ионов.
- заряд ионов.
Ионная сила дает характеристику раствору, т.к. свойства раствора оцениваются суммарным вкладом всех ионов раствора, их концентраций и зарядом.
Зная состав раствора можно рассчитать его ионную силу, далее коэффициент активности и активность и предсказать его свойства.
При уменьшении концентрации уменьшается ионная сила, коэффициенты активности возрастают, при максимальном разведении стремятся к 1. Т.е. активность приблизительно равна концентрации. И наоборот, с увеличением концентрации раствора, ионная сила растет, уменьшается коэффициент активности и активность. При больших концентрациях коэффициент активности и достигает значений выше 1. Это обусловлено увеличением подвижности ионов, которые практически лишены сольватной оболочки (нехватка растворителя).
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1345; Нарушение авторских прав?; Мы поможем в написании вашей работы!