
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Температура кипения и замерзания разбавленных растворов нелетучих веществ
|
|
|
|
Следствием понижения давления пара растворителя является то, что температура кипения раствора, т. е. температура при которой давление его пара становится равным атмосферному, должна быть выше, чем для чистого растворителя. Схематически это показано на рисунке 6.3, где 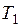 и
и 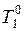 – соответственно температура кипения раствора и растворителя, и
– соответственно температура кипения раствора и растворителя, и 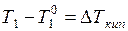 – повышение температуры кипения. При температуре кипения
– повышение температуры кипения. При температуре кипения 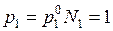 атм. Логарифмируя это уравнение и дифференцируя по температуре, получим
атм. Логарифмируя это уравнение и дифференцируя по температуре, получим
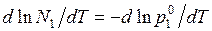 .
.

Рис. 6.3. Повышение температуры кипения раствора
Так как по уравнению Клапейрона – Клаузиуса 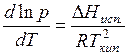 , то
, то 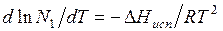 , где
, где 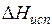 – молярная теплота испарения растворителя из раствора.
– молярная теплота испарения растворителя из раствора.
Интегрирование в интервале между 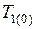 и
и 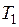 дает
дает
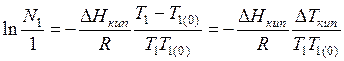 . (6.17)
. (6.17)
Для разбавленных растворов N 2 << N 1, т. е. при разложении в ряд выражения 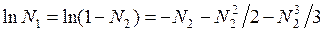 можно ограничиться первым членом с точностью до 1%, если N 2 < 0,02. В случае разбавленных растворов
можно ограничиться первым членом с точностью до 1%, если N 2 < 0,02. В случае разбавленных растворов 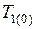 и
и 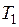 различаются незначительно и произведение
различаются незначительно и произведение 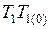 может быть заменено
может быть заменено 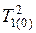 , а величина
, а величина 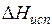 не отличается заметно от теплоты испарения чистого растворителя. Таким образом, из уравнения (6.17) следует, что
не отличается заметно от теплоты испарения чистого растворителя. Таким образом, из уравнения (6.17) следует, что
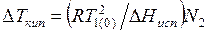 .
.
Выразим концентрацию раствора через моляльность Сm. Пусть раствор содержит n молей растворенного вещества в 1000 г растворителя. В этом случае 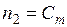 . Если молярная масса растворителя M 1, то
. Если молярная масса растворителя M 1, то 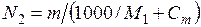 . В разбавленном растворе можно пренебречь величиной Сm по сравнению с 1000/ М 1, тогда
. В разбавленном растворе можно пренебречь величиной Сm по сравнению с 1000/ М 1, тогда 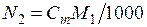 . Отсюда
. Отсюда
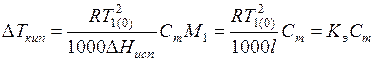 , (6.18)
, (6.18)
где l – удельная теплота испарения растворителя; 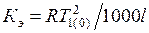 – постоянная величина – эбуллиоскопическая константа, которая характеризует свойства растворителя.
– постоянная величина – эбуллиоскопическая константа, которая характеризует свойства растворителя.
Из уравнения (6.18) следует, что повышение температуры кипения разбавленного раствора не зависит от природы растворенного вещества, а определяется только природой растворителя и моляльностью. Таким образом, величина К э характеризует повышение температуры кипения раствора, содержащего 1 моль любого вещества в 1000 г растворителя. В действительности К э может и не быть равной повышению температуры кипения моляльного раствора, так как при такой концентрации необязательно сохраняются свойства разбавленного раствора. Поэтому К э обычно определяют экстраполяцией на нулевую концентрацию отношения 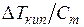 . Уравнение (6.18) было подтверждено многочисленными опытными данными. Впоследствии будет показано, что оно неприменимо в такой простой форме к растворам электролитов.
. Уравнение (6.18) было подтверждено многочисленными опытными данными. Впоследствии будет показано, что оно неприменимо в такой простой форме к растворам электролитов.
В качестве примера вычислим величину К э для воды (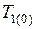 =373 К, а l = 539 кал/г):
=373 К, а l = 539 кал/г):
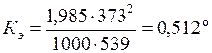 .
.
Из уравнения (6.18) следует, что измерения температур кипения растворов могут служить для определения молекулярной массы растворенного вещества (эбуллиоскопический метод). Если масса растворителя m 1, а растворенного вещества с молекулярной массой М 2 – m 2, то моляльность
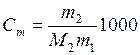 , откуда
, откуда 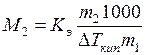 .
.
Другим следствием понижения давления пара раствора нелетучим растворенным веществом является то, что температура замерзания раствора становится ниже, чем чистого растворителя. Температура замерзания чистого растворителя определяется условием равенства давления его пара над жидкой и твердой фазами. Если при замерзании раствора выделяется чистый растворитель, то давление пара над раствором также должно быть равно давлению растворителя в твердом состоянии. Как видно из рис. 6.4, это приводит к понижению температуры замерзания раствора.

Рис. 6.4. Понижение температуры замерзания раствора
Используя такие же соображения, как при выводе уравнения (6.18), легко получить из уравнения 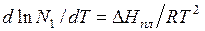 выражение для понижения температуры кристаллизации (замерзания):
выражение для понижения температуры кристаллизации (замерзания):
 и
и 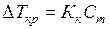 (6.19)
(6.19)
где К к – криоскопическая постоянная, т.е. понижение температуры замерзания моляльного раствора, определяемое уравнением
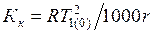 ,
,
здесь r – удельная теплота плавления растворителя; 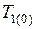 – его температура плавления (замерзания).
– его температура плавления (замерзания).
Величина К к зависит только от свойств растворителя. Поэтому понижение температуры замерзания разбавленных растворов в данном растворителе определяется только концентрацией растворенного вещества.
Применение уравнения (6.19) может быть показано на примере железа, теплота плавления которого составляет 62,74 кал/г, а температура плавления 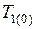 = 1812 К и К к = 1,985·18122/(1000·62,74) = 101,5 К.
= 1812 К и К к = 1,985·18122/(1000·62,74) = 101,5 К.
Таким образом, если из расплава кристаллизуется чистое железо, то понижение температуры плавления в расчете на 1 моль растворенного вещества в 1000 г железа должно составлять 101,5 ºС. Это наблюдается с известным приближением для растворов серы и бора в железе (М (S) = 32 г/моль, М (B) = 10,82 г/моль).
В случае 1%-ного раствора серы в железе экспериментально найденное понижение температуры плавления раствора составляет 30º. Моляльность такого раствора С m = 10:32 ≈ 0,31 и 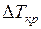 = 101,5·0,31 = 32 К.
= 101,5·0,31 = 32 К.
В случае 1% раствора бора в железе температура плавления раствора понижается на 90 К, моляльность С m = 10:10,82 = 0,92 и 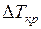 = 101,5·0,92 = 93,4 К.
= 101,5·0,92 = 93,4 К.
Уравнение (6.19) также может быть использовано для определения молекулярной массы растворенного вещества (криоскопический метод):
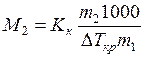
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 916; Нарушение авторских прав?; Мы поможем в написании вашей работы!