
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон действующих масс для разбавленных растворов
|
|
|
|
Пусть вещества A, В и D находятся в растворе:
А(раствор) + В(раствор) = 2D(раствор).
Запишем выражения для химических потенциалов веществ А, В и D при равновесии:

где С А, С B и C D, – концентрации. Отсюда
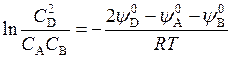
Так как величины  зависят только от Т, то при постоянной температуре
зависят только от Т, то при постоянной температуре  .
.
Таким образом, для разбавленных растворов закон действующих масс применим в таком же виде, как и для идеальных газов. Для разбавленных растворов концентрации, выраженные различными способами, пропорциональны друг другу, поэтому при любом способе их выражения величина К остается постоянной. Разумеется, что как численные значения К, так и величины изменения свободной энергии при реакции (например, стандартные величины 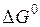 ) зависят от выбранных единиц концентрации. В качестве стандартных могут быть выбраны растворы различных концентраций, например моляльный 1%- или 0,1%-ный. Если концентрация выражается в массовых процентах, то часто
) зависят от выбранных единиц концентрации. В качестве стандартных могут быть выбраны растворы различных концентраций, например моляльный 1%- или 0,1%-ный. Если концентрация выражается в массовых процентах, то часто 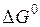 относят к реакции в растворе, где все участники реакции имеют концентрации, равные 1%, а остальное составляет растворитель. Закон действующих масс в приведенной выше форме применим и для реакции в системах, состоящих из нескольких фаз, если они являются разбавленными растворами. Например, важнейшая реакция сталеплавильного производства – обезуглероживание – протекает с участием двух жидких фаз (сталь и шлак) и газовой:
относят к реакции в растворе, где все участники реакции имеют концентрации, равные 1%, а остальное составляет растворитель. Закон действующих масс в приведенной выше форме применим и для реакции в системах, состоящих из нескольких фаз, если они являются разбавленными растворами. Например, важнейшая реакция сталеплавильного производства – обезуглероживание – протекает с участием двух жидких фаз (сталь и шлак) и газовой:
[С] + (FeO) = [Fe] + (CO)(г)
Выражая концентрации в массовых процентах и считая растворы С в железе и FeO в шлаке разбавленными, найдем, что при равновесии
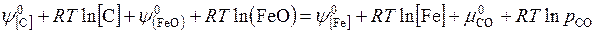 .
.
Принимая во внимание, что [Fe] ≈ 100, введем эту постоянную величину в константу равновесия, тогда
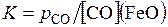
Оксид углерода (II) может выделяться с достаточной скоростью из расплавленной стали, если ее давление составляет примерно 1 атмосферу. При высоких температурах и сильном перемешивании стали пузырями СО система металл – шлак – газ близка к равновесию. При этих условиях величина [С] в «кипящей» ванне определяется концентрацией FeO в шлаке.
В ряде случаев (например, при выплавке трансформаторной стали) необходимо достичь очень низкой концентрации углерода 0,002 – 0,003 %. Из приведенного уравнения видно, что для этого следует понижать p CO. Применение вакуумных печей в современной металлургии позволяет выплавлять железо и сталь с минимальным содержанием углерода.
Рассмотрим реакцию, в которой наряду с разбавленным раствором участвуют вещества (одно или несколько) в твердом состоянии, например
А(т) + В(раствор) = D(раствор).
Свободная энергия твердого тела G A зависит только от температуры, поэтому при равновесии
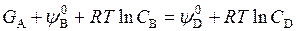 и
и  .
.
Отсюда видно, что равновесие не зависит от количества твердого тела, представляющего собой избыточную фазу (концентрация А не входит в выражение К).
Процесс растворения твердого тела в жидкости можно рассматривать как реакцию
А (т) = А (раствор).
Если образующийся раствор – разбавленный, то константа равновесия численно равна растворимости, т.е. 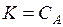 .
.
В соответствии с этим зависимость растворимости от температуры может быть выражена уравнением
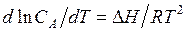 .
.
Если растворение сопровождается поглощением тепла (∆ H > 0), то растворимость увеличивается, при растворении выделяется тепло, растворимость увеличивается при повышении температуры. Наоборот, если при растворении выделяется тепло, то растворимость уменьшается при повышении температуры.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 551; Нарушение авторских прав?; Мы поможем в написании вашей работы!