
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условия проведения окислительно-восстановительного титрования
|
|
|
|
Реакции, применяемые в методах ОВ титрования, должны отвечать ряду требований, важнейшими из которых являются следующие.
1) Реакции должны протекать практически до конца. ОВ реакция
идет тем полнее, чем больше константа равновесия, которая определяется соотношением

Следовательно, чем больше разность ∆E0 = E10 – E20, тем выше константа равновесия, тем полнее протекает реакция. Для реакций типа
А + В = Продукты реакции
при n = 1 и K ≥ 108 (при таком значении К реакция протекает не менее чем на 99,99%) получаем для ∆E0:
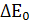 = lgK*0,059 = lg108*0,059 = 0,47
= lgK*0,059 = lg108*0,059 = 0,47
∆E0 ≥ 0,47 В.
2) Реакция должна протекать достаточно быстро, чтобы равновесие, при котором реальные ОВ потенциалы обеих редокс-пар равны, устанавливалось практически мгновенно. Обычно ОВ титрование проводят при комнатной температуре. Однако в случае медленно протекающих ОВ реакций растворы иногда нагревают, чтобы ускорить ход реакции. Так, реакция окисления оксалат-ионов C2O42⁻ перманганат-ионами в кислой среде при комнатной температуре идет медленно. Однако при 70 - 80 °С она протекает достаточно быстро.
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2 + 8H2O
Mn+7 + 5ē → Mn+2 |2
C2O4⁻2 - 2ē → 2CO2 |5
2MnO4⁻ + 5C2O4⁻2 + 16H+ = 2Mn+2 + 10CO2 + 8H2O
Для ускорения достижения равновесия применяют также гомогенные катализаторы. В рассматриваемом примере, содержащим C2O42⁻, реакция протекает медленно. В связи с этим титруемый раствор нагревают. По мере образования катионов марганца (II), играющих роль гомогенного катализатора, достижение равновесия ускоряется и титрование проводится без затруднений.
3) Реакция должна протекать стехиометрически, побочные процессы должны быть исключены.
4) Конечная точка титрования должна определяться точно и однозначно либо с индикаторами, либо без индикаторов.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 913; Нарушение авторских прав?; Мы поможем в написании вашей работы!