
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые окислительно-восстановительного титрования
|
|
|
|
Кривая ОВ титрования - это графическое представление изменения потенциала раствора в зависимости от объема прибавленного титранта. Обычно кривые ОВ титрования строят в координатах Е-V(T), где E - равновесный ОВ потенциал раствора в данный момент титрования, V(Т) - объем прибавленного титранта, или же в координатах Е - f, где f степень оттитрованности раствора, поскольку ОВ потенциалы зависят от концентраций окисленной и восстановленной форм реагентов, участвующих в ОВ реакции. Следовательно, изменение потенциала раствора отражает изменение концентраций реагентов. Наибольшее изменение потенциала раствора наблюдается в ТЭ и вблизи ее, так как в этой области происходит самое большое изменение отношения концентраций окисленной и восстановленной форм редокс-пар. Поэтому именно в этой области и обнаруживается скачок на кривой ОВ титрования.
Расчетные (теоретические) кривые ОВ титрования строят для того,
чтобы определить скачок титрования с целью подбора соответствующего
редокс-индикатора, потенциал изменения окраски которого попадал бы
внутрь скачка на кривой ОВ титрования. Если же при титровании не используется редокс-индикатор, как, например, в перманганатометрии, то построение кривой титрования не имеет практического значения и представляет лишь теоретический интерес.
Рассмотрим построение рассчитанной (теоретической) кривой ОВ титрования на простом примере титрования железа (II) раствором титранта, который содержит окислитель – церий (IV). При титровании протекает ОВ реакция:
Fe2+ + Ce4+ = Fe3+ + Ce3+
X T
В этой ОВ реакции участвует только один электрон, п = 1.
Пусть начальные концентрации с(Х) = c(Fe2+) = 0,1 моль/л: с(Т) = с(Ce4+) = 0,1 моль/л; объем исходного титруемого раствора V(Х) = V(Fe2+) = 100 мл = 0,1 л; V(Т) - объем прибавляемого титранта. Титрант - серно-кислый раствор сульфата церия (IV), титруемое вещество - раствор соли железа (II).
ОВ потенциалы обеих редокс-пар, участвующих в ОВР, определяются уравнением Нерста:
Е1 = Е10 + 0,059lg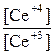 , Е10 = 1,44 В
, Е10 = 1,44 В
Е2 = Е20 + 0,059lg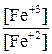 , Е20 = 0,77 В
, Е20 = 0,77 В
Расчет потенциала Е в различные моменты титрования:
1) Е исходного раствора.
Не рассчитывают, т.к. [Fe3+]→ 0, Е1 близок к Е0 = 0,77В
2) Е до ТЭ.
После начала прибавления титранта в титруемом растворе присутствуют уже обе формы редокс-пары Fe3+|Fe2+. Окисленная форма Ce4+ редокс-пары Ce4+|Ce3+ практически отсутствует. В растворе после прибавления каждой порции титранта устанавливается равновесие. Потенциал раствора E равен E = E1 = E2. Однако E1 рассчитать невозможно, так как равновесная концентрация окисленной формы [Ce4+] ничтожно мала и неизвестна. Поэтому до ТЭ потенциал раствора рассчитывают по уравнению Нернста для редокс-пары Fe3+|Fe2+.
E = E2 = 0,77 + 0,059 lg ([Fe3+]/[Fe2+])
Равновесные концентрации равны
[Fe2+] = [c(X)V(X) – c(T)V(T)]/[V(X) + V(T)]
[Fe3+] = c(T)V(T)/[V(X) + V(T)]
Следовательно, E = 0,77 + 0,059 lg {c(T)V(T)/[c(X)V(X) – c(T)V(T)]}
3) Расчет Е в ТЭ:
В ТЭ все Fe2+ оттитровано до Fe3+. В растворе присутствуют Fe3+ и Ce+3 в эквивалентных количествах.
При равновесии [Fe3+] = [Сe3+], [Ce4+] = [Fe2+], тогда 2Е = Е10 + Е20
Е = (Е10 + Е20)/2 = (1,44 + 0,77)/2 = 1,105 В
4) Расчет Е после ТЭ.
При дальнейшем прибавлении титранта после ТЭ в растворе присутствуют Fe3+, Ce3+, и Ce4+; концентрация [Fe2+] ничтожно мала и неизвестна. Поэтому потенциал раствора Е можно рассчитать по уравнению Нернста для редокс-пары Ce4+|Ce3+:
E = E1 = 1,44 + 0,059 lg [(Ce4+]/[Ce3+])
Равновесные концентрации равны
[Ce4+] = [c(T)V(T) – c(X)V(X)]/[V(X) + V(T)]
[Ce3+] = c(X)V(X)/[V(X) + V(T)]
Следовательно
E = 1,44 + 0,059 lg {[c(T)V(T) – c(X)V(X)]/c(X)V(X)}
1) Расчёт до ТЭ
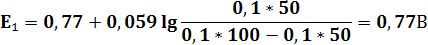
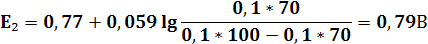
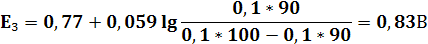
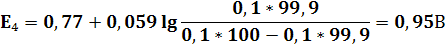
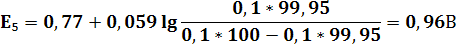
2) Расчёт в ТЭ
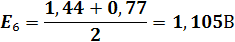
3) Расчёт после ТЭ
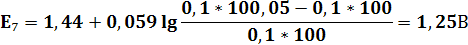



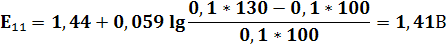
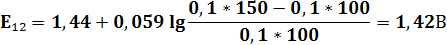
| V(T),мл | 90,9 | 90,95 | 100,05 | 100,1 | ||||||||
| E,В | 0,77 | 0,79 | 0,83 | 0,95 | 0,96 | 1,105 | 1,25 | 1,26 | 1,32 | 1,38 | 1,41 | 1,42 |
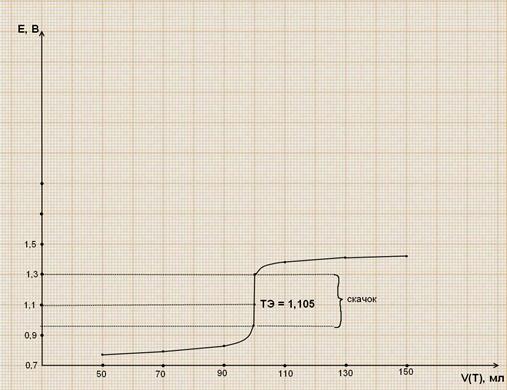
Кривая титрования симметрична относительно ТЭ. Скачок потенциала лежит от 0,9 до 1,3В, ТЭ = 1,105. для определения КТТ можно брать Ind, у которых ОВ-потенциал лежит между 0,9 и 1,3В. Можно брать N – фенилантраниловую кислоту (Е=1,0В) и ферроин (Е=1,106В). Нельзя брать дифиниламин, т.к. его Е=0,76В лежит за пределами скачка титрования.
Кривая титрования имеет вид:
 Индикаторные ошибки окислительно-восстановительного титрования.
Индикаторные ошибки окислительно-восстановительного титрования.
Индикаторные ошибки ОВ титрования появляются тогда, когда для фиксации КТТ применяют редокс-индикаторы. Эти ошибки обусловлены несовпадением потенциалов титруемого раствора в ТЭ и в КТТ. Потенциал в ТЭ равен потенциалу изменения окраски индикатора, а потенциал в ТЭ определяется состоянием раствора, когда количество прибавленного титранта стехиометрически точно соответствует всему количеству титруемого вещества.
Пусть титрант — окислитель, а титруемое вещество — восстановитель (типичная ситуация ОВ титрования). Если потенциал раствора в КТТ меньше его потенциала в ТЭ, то раствор недотитрован, в КТТ имеется некоторое количество неоттитрованного определяемого вещества; индикаторная ошибка ОВ титрования в этом случае считается отрицательной. Если, напротив, потенциал раствора в ККТ больше его потенциала в ТЭ, то раствор перетитрован, в КТТ имеется избыточное количество титранта; индикаторная ошибка ОВ титрования — положительная.
Если п — общее количество титруемого вещества (или прибавленного титранта при перетитровывании раствора), ∆n — избыточное (недотитрованное) количество определяемого вещества (или прибавленного титранта) в растворе в КТТ, то индикаторная ошибка ОВ титрования будет равна по абсолютной величине:
 Х = ∆n ∙ 100%/n
Х = ∆n ∙ 100%/n
Определим индикаторную ошибку при титровании восстановителя (определяемое вещество) окислителем (титрант).
1) Пусть потенциал раствора Е в КТТ меньше его потенциала в ТЭ,
т.е. раствор недотитрован, его потенциал определяется потенциалом Ех
титруемого вещества в КТТ.

Формула и определяет абсолютную величину индикаторной ошибки Х - для случая титрования восстановителя окислителем, когда потенциал раствора в КТТ меньше потенциала раствора в ТЭ.
2) Пусть теперь потенциал раствора Е в КТТ больше потенциала раствора в ТЭ, т.е. раствор перетитрован, его потенциал в КТТ определяется потенциалом ЕТ редокс-пары титранта:
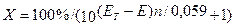
Формула определяет абсолютную величину индикаторной ошибки X для случая титрования восстановителя окислителем, когда потенциал раствора в КТТ больше потенциала раствора в ТЭ.
В практике фармацевтического анализа, когда индикаторная ошибка составляет сотые доли процента или еще меньше, ею обычно пренебрегают.
Считается возможным использование редокс-индикатора для фиксации КТТ тогда, когда индикаторная ошибка титрования с применением этого индикатора не превышает 0,1—0,2%.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 13577; Нарушение авторских прав?; Мы поможем в написании вашей работы!