
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Иодометрия
|
|
|
|
Сущность метода. В основе метода лежит реакция, взаимодействия иодид-ионов с окислителем Ох с образованием иода и восстановителя Red:
2I- + Ox = I2 + Red
Иодид-ион - довольно эффективный восстановитель. Однако растворы иодида калия непосредственно не применяются в качестве титранта, так как они неустойчивы и окисляются кислородом воздуха.
На практике к анализируемому раствору определяемого окислителя прибавляют избыток иодида калия. Иод, выделяющийся в качестве заместителя в количестве, эквивалентном количеству вступившего в реакцию окислителя Ох, оттитровывают стандартным раствором тиосульфата натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Количество израсходованного титранта - раствора тиосульфата натрия - эквивалентно количеству образовавшегося иода и, следовательно, количеству определяемого окислителя Ох, провзаимодействовавшего с иодид-ионами.
Титрант метода. Титрантом метода является стандартный раствор тиосульфата натрия, чаще всего с молярной концентрацией 0,1; 0,02; 0,01 моль/л. Стандартные растворы тиосульфата натрия нельзя готовить по точной навеске, так как кристаллический пентагидрат Na2S2O3 ∙ 5Н2О при хранении частично обезвоживается. Поэтому вначале готовят раствор с приблизительной концентрацией тиосульфата натрия, а затем его стандартизуют.
Растворы тиосульфата натрия при хранении изменяют свой титр из-за неустойчивости тиосульфат-ионов, которые разлагаются в кислой среде с выделением свободной серы (раствор мутнеет):
S2O32- + H+ = HSO3- +S↓
окисляются кислородом воздуха также с выделением свободной серы:
2S2O32- +O2 = 2SO42- + 2S↓
Тиосульфат-ионы в водном растворе разлагаются на свету и в присутствии микроорганизмов.
Растворы тиосульфата натрия наиболее устойчивы при рН ≈ 9 - 10, поэтому для стабилизации растворов в них вводят небольшое количество карбоната натрия Na2CO3, или гидросульфата натрия NaHSO4.
Затем приготовленный раствор стандартизуют. Стандартизацию проводят по йодату калия КIО3, бромату калия KBrO3 дихромату калия К2Cr2O7 и другим окислителям. Чаще всего растворы тиосульфата натрия стандартизуют по стандартному раствору дихромата калия. Для этого к аликвоте раствора дихромата калия, приготовленного по точной навеске, прибавляют избыток раствора иодида калия, раствор HC1 и оставляют на некоторое время в темном месте. При этом протекает реакция
K2Cr2O7 + 6KI + 14HCl = 2CrCl3 + 3I2 + 8KCl + 7H2O
X заместитель B или HCl
K2Cr2O7+ 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
заместитель
Йод, выделившийся в количестве, эквивалентном количеству прореагировавшего дихромата, титруют стандартным раствором тиосульфата натрия в присутствии крахмала в качестве индикатора.
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
заместитель Т
Крахмал прибавляют перед окончанием титрования, когда раствор принимает зеленовато-желтую окраску. Титруют до перехода окраски раствора из синей в светло-зеленую (цвет аквакомплексов хрома(III)).
 Молярную концентрацию тиосульфата натрия рассчитывают, исходя из закона эквивалентов с учетом полуреакций:
Молярную концентрацию тиосульфата натрия рассчитывают, исходя из закона эквивалентов с учетом полуреакций:
2S2O32- - 2е = S4O62-; → М( Na2S2O3) = M(
Na2S2O3) = M( Na2S2O3)
Na2S2O3)
Cr2O72- + 6e + 14H+ = 2Cr3+ + 7H2O; → М( K2Cr2O7) =
K2Cr2O7) = 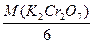
Расчет ведут по формулам косвенного титрования.
n(Na2S2O3) = n(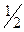 I2) = n(
I2) = n( K2Cr2O7),
K2Cr2O7),
c(Na2S2O3)V(Na2S2O3) = c( K2Cr2O7)V(K2Cr2O7),
K2Cr2O7)V(K2Cr2O7),
c(Na2S2O3) = c( K2Cr2O7)V(K2Cr2O7)/ V(Na2S2O3).
K2Cr2O7)V(K2Cr2O7)/ V(Na2S2O3).
Стандартизованный раствор тиосульфата натрия хранят в сосудах из темного стекла с притертыми пробками в темном месте.
Индикатор метода. В качестве индикатора в иодометрии обычно используют свежеприготовленный 1%-ный раствор крахмала, который прибавляют в титруемый раствор тогда, когда основная часть иода уже оттитрована раствором тиосульфата натрия и титруемый раствор приобрел зеленовато-желтую окраску. После введения крахмала раствор становится синим; продолжают его титрование до перехода синей окраски в светло-зеленую.
Применение иодометрии. Метод применяют для определения таких окислителей, как пероксид водорода Н2О2, пероксиды натрия Na2O2,магния MgO2, бария BaO2, медь(II), дихромат калия, перманганат калия, арсенат-натрия, иод и т.д.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3812; Нарушение авторских прав?; Мы поможем в написании вашей работы!