
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алкени і циклоалкени
|
|
|
|
Алкенами називаються ненасичені вуглеводні, молекули яких містять один подвійний зв”язок. Ато-ми карбону, зв”язані подвійним зв”язком, знаходяться у стані sp2-гібридизації, подвійний зв”язок є комбінацією s - і p - зв”язків. Загальна формула гомологічного ряду алкенів СnН2n. Неграничні (не-насичені) вуглеводні ряду етилену, що містять один подвійний зв”язок, називаються олефінами Структурна ізомерія алкенів обумовлена не тільки будовою карбонового скелету, як це притама-нно алканам, але і положенням подвійного зв”язку в головному карбонвому ланцюгу. Першим гомологом, для якого має місце ізомерія з врахуван-ням цих двох ознак, є алкен C4Н8. Просторова ізомерія алкенів обумовлена наявністю в молекулі подвійного зв”язку і різним розташуванням замісників відносно площини p -зв”язку. Багато алкенів існують у вигляді цис- і транс- ізомерів. Фізичні властивості. За фізичними властивостями алкени мало чим відрізняються від алканів з таким же числом атомів в молекулі. Нижчі гомологи С2—С4 при звичайних умовах – гази, С5—С17 — рідини, вищі гомологи – тверді речовини. Алкени нерозчинні у воді, добре розчинні в органіч-них розчинниках.
Способи отримання. Алкени є цінною сировиною для промислового органічного синтезу. В природі вони практично не зустрічаються, тому розроблено багато методів отримання алкенів різної будови.
1. Крекінг алканів. Крекінг – процеси хімічних перетворень органічних сполук, що тривають при високих температурах. Крекінг алканів є найважливіший промисловий спосіб отримання алкенів з висококип”ячих фракцій нафти. Під дією сильного нагрівання (до 700 оС) в молекулах алканів відбувається гомолітичне розщеплення s -зв”язку С—С, і при цьому утворюється суміш низько-молекулярних алканів і алкенів:
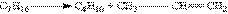
2. Реакції елімінування. Ця група реакцій знаходиться в основі більшості способів отримання алкенів. Елімінування – це відщеплення двох атомів або груп атомів від сусідніх атомів карбону з утворенням між ними -зв”язку. Атоми карбону при цьому переходять із sр3 - в sp2-гібридний стан. Вихідними речовинами можуть бути представники різних класів органічних сполук.
а) Дегідрогалогенування відбувається при дії спиртових розчинів лугів на моногалогеніди:

У випадках, коли сусідні атоми карбону не однакові, відщеплення атомів гідрогену відбува-ється переважно від найменше гідрогенізованого атома карбону. Ця закономірність – правило Зайцева.
б) Дегідратація спиртів відбувається при їх нагріванні з сірчаною кислотою або при пропусканні пари спирту над каталізатором.

в) Дегалогенування має місце при нагріванні дігалогенідів, які мають атоми галогену у сусідніх атомів карбону, з активними металами:

г) Дегідрування алканів проводять при 500 °С в присутності каталізатору:

Хімічні властивості алкенів визначаються наявністю в їх молекулах подвійного зв”язку. Елект-ронна хмара p -зв”язку зазнає атаки електрофільними агентами. Тому багато реакцій алкенів пли-нуть по механізму електрофільного приєднання, що позначається символом AE (від англ. addition electrophilic). Реакції електрофільного приєднання – це іонні процеси, які протікають в декілька стадій. Характерною особливістю електронної хмари p -зв”язку є його рухливість. Під впливом замісників електронна щільність p -зв”язку може зміщуватися до одного з атомів карбону. Тоді p -зв”язок стає полярним а на атомах карбону, що зв”язані подвійним зв”язком, виникають часткові заряди. Підвищення полярності кінець-кінцем може призвести до гетеролітичного розриву p -зв”язку.

1. Гідрогалогенування. При взаємодії алкенів з галогенгідрогенами (НСl, НВr) утворюються галогеналкани, причому якщо вихідний алкен несиметричний, реакція плине за правилом Марковникова.
Правило Марковнікова: при приєднанні полярних молекул типу НХ до несиметричних алкенів гідроген приєднується до більш гідрогенізованого атому карбону при подвійному зв”язку:

2. Гідратація. При взаємодії алкенів з водою в присутності мінеральних кислот (сірчаної, фосфор-ної) утворюються спирти. Мінеральні кислоти виконують роль каталізаторів і є джерелом протонів. Приєднання води відбувається за правилом Марковнікова:

3. Галогенування. При додавання до алкену брому (у вигляді бромної води) буре забарвлення брому швидко зникає. Ця реакція є якісною на подвійний зв”язок:

4. Окиснення. При окисненні алкенів перманганатом калію КMnO4 в нейтральному або слабоос-новному середовищі відбувається розрив p -зв”язку і приєднання гідроксильної групи до кожного атому карбону, тобто реакція гідроксилювання. В результаті реакції забарвлений розчин КMnO4 швидко знебарвлюється і випадає коричневий осад оксиду марганцю (IV). Ця реакція також є якісною на подвійний зв”язок. При окисненні перманганатом калію в кислому середовищі або хро-мовою сумішшю відбувається повний розрив подвійного зв”язку із утворенням продуктів окиснен-ня. Ця реакція – окислювальне розщеплення подвійного зв”язку. Так, з молекули бутена-2 в резуль-таті окислювального розщеплення утворюється дві молекули оцтової кислоти:
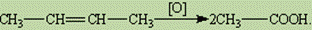
5. Відновлення (гідрування). Ця реакція йде в присутності каталізатору – мілко подрібненого нікелю, платини або паладію – при кімнатній температурі:
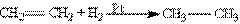
При гідрогенізації олефіни перетворюються в насичені вуглеводні.
6. Реакції полімерізації. Особливим типом реакцій приєднання до алкенів є їх полімерізація, яка може каталізуватися як електрофілами, так і радикалами або сполуками перехідних металів. Реакція полімерізації – це послідовне приєднання молекул ненасичених сполук одна до одної з утворенням високомолекулярного продукту – полімера. Молекули алкена, які вступають в реакцію полімерізації – мономери. Число елементарних ланок, які повторюються в макромолекулі, назива-ється ступінню полімерізації (n). В залежності від ступеню полімерізації з одних і тих же моно-мерів можна отримувати речовини з різними властивостями. Так, поліетилен з короткими ланцю-гами (n = 20) є рідиною, що має мастильні властивості. Поліетилен з довжиною ланцюгу в 1500-2000 ланок представляє собою твердий, але гнучкий пластичний матеріал, із якого можна отриму-вати плівки, виготовляти пляшки і іншу посуду, еластичні труби та ін. Нарешті, поліетиен з довжи-ною ланцюгу 5-6 тис. ланок є твердою речовиною, із якої можна виготовляти литі вироби, жорсткі труби, міцні нитки.
Якщо в реакції полімерізації приймає участь невелика кількість молекул, то утворюються низь-комолекулярні речовини, наприклад дімери, тримери і т.ін. Умови перебігу реакцій полімерізації доволі різоманітні. В деяких випадках потрібні каталізатори і високий тиск. Але головним факто-ром є будова молекули мономеру. В реакцію полімерізації вступають ненасичені сполуки за раху-нок розриву кратних зв”язків.
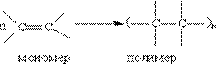
Полімерізація – це ланцюгова реакція і для того, щоб вона розпочалася, необхідно активувати молекули мономеру за допомогою так званих ініціаторів. Таким ініціаторами реакції можуть бути вільні радикали або іони (катіони, аніони). В залежності від природи ініціатору розрізняють радикальний, катіонний або аніонний механізми полімерізації. Найбільш розповсюджені полімери вуглеводневої природи – поліетилен і поліпропілен.
Поліетилен отримують полімерізацією етилену.
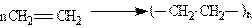
Поліпропілен отримують стереоспецифічною полімерізацією пропілену (пропену). Стереоспеци-фічна полімерізація – це процес отримання полімеру зі строго упорядкованою просторовою будо-вою. До полімерізації здатні багато інших сполук – похідні етилену, що мають загальну формулу СН2==СН—X, де Х — різні атоми або групи атомів.
Застосування. Етилен застосовується для отримання етилового спирту, поліетилену. Він приско-рює дозрівання плодів (томатів, цитрусових і др.) при введенні невеликої кількості його у повітря теплиць. Етилен і його гомологи використовуються як хімічна сировина для синтезу багатьох органічних речовин.
Дієнові вуглеводні (алкадієни). Алкадієнами називаються ненасичені вуглеводні, які містять два подвійних зв”язки. Загальна формула алкадієнів - СnН2n-2. Якщо подвійні зв”язки розділені в лан-цюгу двома або більшою кількістю s -зв”язків (пентадієн-1,4), то такі подвійні зв”язки називаються ізольованими. Хімічні властивості алкадієнів з ізольованими подвійними зв”язками такі ж як і у алкенів з тою різницею, що в реакції можуть вступати не один, а два подвійних зв”язки незалежно один від одного. Якщо подвійні зв”язки в ланцюгу розділені тільки одним s -зв”язком, то їх нази-вають спряженими. В такому разі в молекулі подвійні і одинарні зв”язки чередуються, як, напри-клад, в бутадієні-1,3 СН2==СН—СН==СН2, який є найпростішим спряженим алкадієном. Сполуки з таким розміщенням подвійних зв”язків відрізняються за властивостями як від алкенів, так і від інших типів алкадієнів. Особливості хімічної поведінки таких сполук пояснюються наявністю спряження. Спряження – це утворення єдиної електронної хмари в результаті взаємодії негібри-дизованих р-орбіталей в молекулі з подвійними і одинарними зв”язками, що чередуються. У спря-женій системі p -електрони вже не належать конкретним зв”язкам, вони делокалізовані (розподілені по всій спряженій системі, по всім зв”язкам і атомам). Ланцюг спряження може включати велику кількість подвійних зв”язків. Чим він довше, тим більше делокалізація p -електронів і тим більш стійка молекула.
Способи отримання. Важливе промислове значення має бутадиен-1,3, або дивинил, тому що він є сировиною для виробництва синтетичного каучуку. Бутадієн-1,3 отримують із бутанової фракції крекінг-процесу нафти. При температурі 600 оС відбувається ступіньчасте дегідрування бутану над каталізатором (Сr2О3, Al2О3) з утворенням бутадієну-1,3:
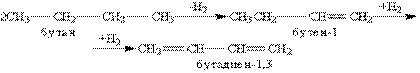
Каталітичний спосіб отримання бутадієну-1,3 з етанолу був відкритий у 1932 р. С.В.Лебедєвим. За цим способом бутадієн-1,3 отримується в результаті одночасного дегідрування і дегідратації етанолу з каталізаторами на основі ZnO і Аl2О3:
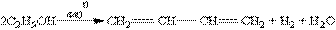
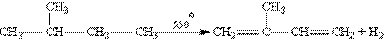
Другий важливий представник алкдієнів - 2-метилбутадієн-1,3, або і зопрен, який є легкокиплячою рідиною. Ізопрен вперше був отриманий з натурального каучуку сухою перегонкою (нагріванням без доступу повітря). В нинішній час в промисловості ізопрен отримують головним чином із лег-ких фракцій вуглеводнів, що утворюються при крекінг-переробці нафти, наприклад при дегідру-ванні 2-метилбутану на оксидних каталізаторах:
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1824; Нарушение авторских прав?; Мы поможем в написании вашей работы!