
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи отримання
|
|
|
|
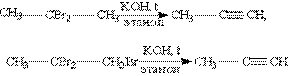
1. Загальним способом отримання алканів є реакція дегідрогалогенуванняя – відщеплення двох молекул галогенгідрогену від дігалогензаміщених алканів, які містять два атоми галогену біля сусідніх атомів карбону (наприклад, 1,2-дібромпропан), або у одного атому карбону (2,2-дібром-пропан). Реакція відбувається під дією спиртового розчину гідроксиду калію:
2. Найважливіший з алкінів – ацетилен отримують в промисловості шляхом високотемпературного крекінгу метану:
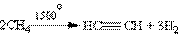
В лабораторії ацетилен можна отримати гідролізом карбіду кальцію:

Хімічні властивості. Потрійний зв”язок утворюється між двома атомами карбону в sp-гібридному стані. Два s -зв”язки розташовані під кутом 180о, а два p -зв”язки розміщені у взаємно перпенди-кулярних областях. Наявність p -зв”язків обумовлює здатність алкінів вступати в реакції електро-фільного приєднання. Але ці реакції для алкінів плинуть повільніше ніж для алкенів. Це поясню-ється тим, що p -електронна щільність потрійного зв”язку розташована більш комплексно, ніж в алкенах, і тому менш доступна для взаємодії з різними реагентами.
1. Галогенування. Галогени приєднуються до алкінів в дві стадії. Наприклад. Приєднання брому до ацетилену призводить до утворення діброметену, який, в свою чергу, реагує з надлишком брому з утворенням тетраброметану:
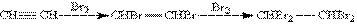
2. Гідрогалогенування. Галогенгідрогени приєднуються до потрійного зв”язку трудніше ніж до подвійного. Для активації галогенгідрогену використовують АlСl3 — сильну кислоту Льюіса. Із ацетилену при цьому можна отримати вінілхлорид (хлоретен), який використовується для отримання важного полімеру – полівінілхлориду:
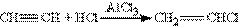
3. Гідратація. Приєднання води до алкінів каталізується солями ртуті (П) (реакція Кучерова)
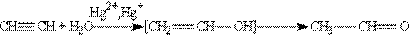
На першій стадії реакції утворюється ненасичений спирт, в якому гідроксогрупа розташована безпосередньо у атому карбону при подвійному зв”язку. Такі спирти прийнято називати вініловими або єнолами. Відмінною рисою більшості єнолів є їх нестійкість. В момент утворення вони ізомерізуються в більш стабільні карбонільні сполуки (альдегіди або кетони) за рахунок переносу протону від гідроксильної групи до сусіднього атому карбону при подвійному зв”язку. При цьому p -зв”язок між атомами карбону розривається і утворюється p -зв”язок між атомом карбону і атомом кисню. Причиною ізомерізації є більш міцний подвійний зв”язок С == О у порівнянні з подвійним зв”язком С == С. В результаті реакції гідратації тільки ацетілен перетворюється в альдегід, гідратація гомологів ацетілену відбувається за правилом Марковнікова і єноли, що утворюються, ізомерізуються в кетони. Так, пропин перетворюється в ацетон:
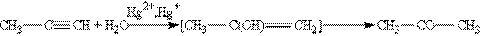
4. Кислотні властивості. Особливістю алкінів, що мають кінцевий потрійний зв”язок, є їх здат-ність відщеплювати протон під дією сильних основ, тобто виявляти слабкі кислотні властивості. Можливість відщеплення протону обумовлена сильною полярізацією s -зв”язку º С¬ Н. Причиною поляризації є висока електронегативність атому карбону в sp-гібридному стані. Тому алкіни, на відміну від алкенів і алканів, здатні утворювати солі, які називають ацетиленідами.

Ацетиленіди срібла і міді (І) легко утворюються і випадають в осад при пропусканні ацетилену через аміачний розчин оксиду срібла або хлориду міді (І). Ця реакція служить для виявлення алкинів з потрійним зв”язком на кінці ланцюгу:
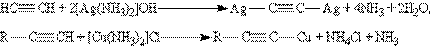
Ацетиленіди срібла і міді як солі дуже слабких кислот легко розкладаються при дії хлорогід-рогенної кислоти з виділенням вихідного алкіну:

Таким чином, використовуючи реакції утворення і розкладання ацетиленідів, можна виділити алкіни із сумішей з іншими вуглеводнями.
5. Полімерізація. В присутності каталізаторів алкіни можуть реагувати один з одним, причому в залежності від умов утворюються різні продукти. Так під дією водного розчину CuCl2 і NH4Cl ацетілен димерізується, що дає вінілацетилен:

Він має високу реакційну здатність; приєднуючи хлоргідроген, він утворює хлоропрен, який використовують для отримання штучного каучуку:
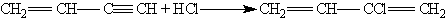
При пропусканні ацетилену над активованим вугіллям при 600 оС відбувається тримерізація ацетилену з утворенням бензолу:
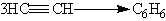
6. Реакції окиснення і відновлення. Алкіни окиснюються різними окисниками, в т.ч. перманганатом калію. При цьому розчин перманганату калію обезбарвлюється, що служить вказівкою на наявність потрійного зв”язку. При окисненні зазвичай відбувається розщеплння потрійного зв”язку і утворю-ються карбонові кислоти:

В присутності металевих каталізаторів алкіни відновлюються шляхом послідовного приєднання молекул гідрогену, перетворюючись спочатку в алкени, а потім в алкани:
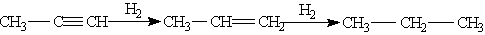
Застосування. Ацетилен використовується в якості вихідної сировини для багатьох промислових хімічних синтезів. З нього отримують оцтову кислоту, штучний каучук, полівінілхлоридні смоли. Тетрахлоретан СНСl2—CHCl2 — продукт приєднання хлору до етилену — служить добрим розчинником жирів і багатьох органічних речовин і, що дуже важливо, є безпечним в пожарному відношенні. Ацетилен використовують для автогенного зварювання металів.
5. Ароматичні вуглеводні (арени)
Ароматичними вуглеводнями (аренами) називаються речовини, в молекулах яких міститься одне або декілька бензольних кілець – циклічних груп атомів карбону з особливим характером зв”язків. Поняття „бензольне кільце” потребує розшифровки. Перша структура бензолу була запропонована у 1865 р. німецьким вченим А.Кекуле:
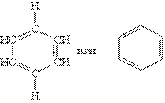
Ця формула правильно відображає рівнозначність шести атомів карбону, але не пояснює ряд особливих властивостей бензолу. Наприклад, не дивлячись на ненасиченість, бензол не виявляє схильності до реакцій приєднання: він не знебарвлює бромну воду і розчин перманганату калію, тобто не дає типових для ненасичених сполук якісних реакцій. Особливості будови і властивостей бензолу вдалося повністю пояснити тільки завдяки розвитку сучасної квантово - механічної теорії хімічних зв”язків. Згідно з сучасними уявленнями, всі шість атомів карбону в молекулі бензолу знаходяться в sp2-гібридному стані. Кожний атом карбону утворює s -зв”язки з двома іншими атомами карбону і одним атомом гідрогену, які лежать в одній площині. Валентні кути між трьома s -зв”язками дорівнюють 120о. Таким чином, всі шість атомів карбону лежать в одній площині, утворюючи правильний шестикутник ( s -скелет молекули бензолу). Кожний атом карбону має одну негібридизовану р-орбіталь. Шість таких орбіталей розміщуються перпендикулярно плоскому s -скелету і паралельно одна одній (див. рис.а). Всі шість електронів взаємодіють між собою, утворюючи p -зв”язки, не локалізовані в пари як при утворенні подвійних зв”язків, а об”єднані в єдину p -електронну хмару. Таким чином, в молекулі бензолу відбувається кругове спряження. Найбільша p -електронна щільність в цій спряженій системі розташовується над і під площиною s -скелету (див. рис.б).
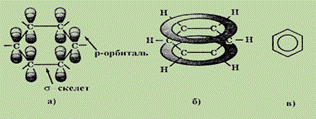
В результаті всі зв”язки між атомами карбону в бензолі мають довжину 0,139 нм. Ця величина є проміжною між довжиною одинарного зв”язку в алканах (0,154 нм) і подвійного зв”язку в алкенах (0,133 нм). Рівнозначність зв”язків прийнято зображати кружком всередині циклу (див. рис. в). Кругове спряження дає виграш в енергії 150 кДж/моль. Ця величина складає енергію спряження – кількість енергії, яку потрібно витратити, щоб порушити ароматичну систему бензолу. Така електронна будова пояснює всі особливості бензолу. Так, зрозуміло чому бензол важко вступає в реакції приєднання, - це привело б порушення спряження. Такі реакції можливі лише в дуже жорстких умовах.
Умовно арени можна розділити на два ряди. До першого відносять похідні бензолу (наприклад, толуол чи діфеніл), до другого – конденсовані (поліядерні) арени (простіший з них – нафталін):
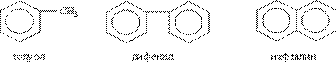
Гомологічний ряд бензолу відповідає загальній формулі С6Н2n-6. Структурна ізомерія в гомологічному ряду бензолу обумовлена взаємним розташуванням замісників в ядрі. Моно-заміщені похідні бензолу не мають ізомерів положення, бо всі атоми в бензольному ядрі рівнозначні. Дізаміщені похідні існують у вигляді трьох ізомерів,
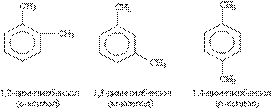
які відрізняються взаємним розташуванням замісників. Положення замісників вказують цифрами або приставками: орто- (о-), мета- (м-), пара- (п-). Радикали ароматичних вуглеводнів називають арильними радикалами. Радикал С6Н5 — називається феніл.
Фізичні властивості. Перші члени гомологічного ряду бензолу (наприклад, толуол, етилбензол і др.) – безбарвні рідини із специфічним запахом. Вони легше води і нерозчинні в ній. Добре розчиняються в органічних розчинниках. Бензол та його гомологи самі є добрими розчинниками для багатьох органічних речовин. Всі арени горять кіптявим полум”ям завдяки високому вмісту карбону в їх молекулах.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 715; Нарушение авторских прав?; Мы поможем в написании вашей работы!