
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 2 Химическая кинетика и равновесие
|
|
|
|
Семестр. Лекция 1
Конспект предназначен для студентов 1 курса профильных специальностей СПбГМТУ (корфак, машфак, приборфак). 2 семестра обучения. 1 семестр – зачет, 2 семестр – экзамен. Допуск к экзамену получается либо по результатам лабораторных занятий, либо путем сдачи федерального интернет-теста по химии.
Рекомендуемая литература:
1. А.Б. Никольский, А.В. Суворов «Общая химия».
2. А.А.Хоникевич. «Химия и коррозия в судостроении».
Читаемый курс «Химия» является инженерным, в первом семестре рассматриваются отдельные теоретические положения современной химии: химическая термодинамика и кинетика, теория растворов, природная и техническая вода, химические источники тока и процессы электролиза. Во втором семестре основное внимание уделено химическому сопротивлению материалов и защите от коррозии.
Основные понятия:
Молекула – наименьшая частица вещества, способная к самостоятельному существованию и обладающая химическими свойствами данного вещества.
Атомная единица массы - 1/12 часть массы атома углерода.
Моль – количество вещества, содержащее Авогадрово число структурных единиц (атомов, молекул, ионов, электронов и т.п.). Число Авогадро NA = 6,02 · 1023.
Масса одного моля (объем) - молярная масса (объем). Vмоля газа=22,4л, при нормальных условиях (н.у). Т=0оС, Р=1атм=760 мм рт.ст. В химии чаще применяются стандартные условия: Т=25оС=298К. Все стандартные величины, функции обозначаются верхним индексом «о», например Но,So.
Коэффициенты в уравнении химической реакции могут означать число реагирующих молекул веществ или их числа молей:
2H2 + O2 = 2H2O; H2 + ½ O2 = H20.
2 моля (молекулы) H2 + 1 моль (молекула)O2 = 2 моля (молекулы) H2O
2·2г + 32г = 2·18г. При использовании дробных коэффициентов речь идет только о числах молей.
Необходимое условие реакции
Химическая система – тело или группа тел, мысленно изолированных от окружающей среды. Однородная система называется гомогенной, система, содержащая поверхности, отделяющие части с различными свойствами, называется гетерогенной. Совокупность гомогенных частей системы называется фазой. Обозначение фаз веществ в реакции: [ ] – твердая фаза; { } – жидкая фаза; () – газовая фаза.
Важнейший признак химической реакции – тепловые изменения. DQ>0 означает выделение тепла, экзотермическую реакцию, DQ<0 – поглощение тепла, эндотермическую реакцию. Наблюдатель – в окружающей среде, которая получает тепло, поэтому «+». В химии принято рассматривать процесс с точки зрения системы. Процесс при постоянном объеме системы называется изохорным, а при постоянном давлении – изобарным.
Тепловой эффект химической реакции в изобарных условиях c противоположным знаком называется изменением энтальпии:
-(DQ) р=const = DH
Н = U + PV
DH = DU + PDV,
U – внутренняя энергия системы, P,V – давление и объем
Закон Лавуазье-Лапласа. Тепловой эффект прямой реакции равен с противоположным знаком эффекту обратной реакции.
Закон Н.Гесса (1840 г.) Тепловой эффект зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий процесса.
DU = U2 - U1

Рис.1.1 Функция состояния системы
Внутренняя энергия – функция состояния системы, не зависит от пути перехода из состояния 1 в состояние 2. Гесс доказал, что и тепловой эффект реакции обладает таким же свойством. Например, рассмотрим процесс горения углерода.
С + О2 = СО2 DH1 = - 393,5 кДж/моль
1.С + 1/2О2 = СО DH2
2.СО + 1/2О2 = СО2 DH3
DH1 =DH2 + DH3

Рис.1.2 Закон Гесса
Это свойство независимости теплового эффекта от пути процесса может быть использовано для определения DH любой реакции расчетным путем, например, вычислим тепло при горении метана:
СН4 + 2О2 = СО2 + 2Н2О (г) DH =?
Представим себе следующие мысленные стадии этой реакции:
1. СН4 = С + 2Н2 + 74,85 кДж/моль
2. С + О2 = СО2 - 393,5 кДж/моль
3. 2Н2 + О2 = 2Н2О(г) - 2 ·241,8 кДж/моль
Искомый тепловой эффект равен сумме эффектов промежуточных стадий:
DH = (+ 74,85 - 393,5 - 2 ·241,8) кДж.
Тепловой эффект реакции образования одного моля сложного вещества из простых тел называется стандартной энтальпией образования. Это табличные данные, важнейшая характеристика любого сложного вещества.
DHо обр (простого вещества) º0
DHоСО2 = - 393,5 кДж/моль и так далее. Как правило, при образовании сложного вещества из простых тел тепло выделяется, эндотермические соединения неустойчивы (табл.1.1).
Таблица 1.1
Термодинамические характеристики некоторых веществ при стандартных условиях (Т=298К, Р= 760 мм рт.ст)
| Вещество | Состояние | DНо298, КДж/моль | So298, Дж/моль·К | Вещество | Состояние | DНо298, КДж/моль | So298, Дж/моль·К |
| AI2O3 | Тв | -1675 | 50,94 | H2 | Газ | 130,6 | |
| AI2(SO4)3 | Тв | -3434 | 239,2 | H2O | Газ | -241,84 | 188,74 |
| C | Тв (графит) | 5,74 | H2O | Жидк | -285,84 | 69,96 | |
| СО | Газ | -110,5 | 197,4 | Н2О2 | Жидк | 81,35 | 75,91 |
| СО2 | Газ | -393,5 | 213,6 | I2 | Тв | 116,6 | |
| CS2 | Газ | 115,3 | 237,8 | HI | Газ | 25,94 | 206,3 |
| CH4 | Газ | -74,85 | 186,19 | MgO | Тв | -601,24 | 26,94 |
| С2Н2 | Газ | 226,75 | 200,8 | Mn | Тв | 31,7 | |
| С2Н4 | Газ | 52,28 | 219,4 | MnCI2 | Тв | -482,0 | 117,0 |
| С2Н6 | Газ | -84,67 | 229,5 | N2 | Газ | 191,5 | |
| С3Н8 | Газ | -103,9 | 269,9 | NO | Газ | 90,37 | 210,62 |
| CH3OH | Жидк | -238,7 | 126,7 | NO2 | Газ | 33,89 | 240,45 |
| С2Н5ОН | Жидк | -277,5 | - | N2O4 | Газ | 9,37 | 304,3 |
| СаО | Тв | -635,1 | 39,7 | NH3 | Газ | -45,98 | 192,28 |
| Са(ОН)2 | Тв | -986,5 | 83,4 | NH4CI | Тв | -315,39 | 94,5 |
| CI2 | Газ | 223,0 | О2 | Газ | 205,03 | ||
| HCI | Газ | -92,31 | 186,7 | SO2 | Газ | -297,78 | 248,29 |
| Fe | Тв | 27,56 | SO3 | Газ | -395,01 | 255,98 | |
| Fe2O3 | Тв | -821,32 | 89,96 | SiO2 | Тв (кварц) | -859,3 | 42,09 |
| Fe3O4 | Тв | -1117,7 | 151,46 | H2S | Газ | -20,06 | 205,45 |
Для любой реакции
n1 А1 + n2 А2 + ni Аi = n1 B1 + n2 B2 + nj Bj i ¹ j
следствие из закона Гесса может быть представлено в виде:
DH = S nj DHоBj - S ni DHоАi.
j i
Границы применимости закона Гесса обозначены при обсуждении постулатов (начал) термодинамики, запрещающих так называемые «вечные» двигатели. Первое начало представляет собой закон сохранения энергии для процессов с участием тепловой формы энергии. Изменение внутренней энергии системы DU может быть выражено тепловым эффектом, механической и всеми другими видами работы:
DU = DQ - А мех + S Аi.
А мех = PDV, и при отсутствии всех видов работы кроме механической:
DU = DQ - PDV.
а) V=const DU = DQ, то есть тепловой эффект представляет собой изменение внутренней энергии системы, является тем самым функцией состояния системы.
б) Р=const DQ = DU + PDV = D(U + PV) = DH, в изобарных условиях тепловой эффект есть изменение энтальпии, тоже функции состояния.
При добавлении других видов работы, например, электрической, приведенные рассуждения несправедливы и тепловой эффект будет сильно зависеть от пути реакции. Окислительно-восстановительный процесс может быть реализован химически или электрохимически в топливном элементе, тепловой эффект при этом не только способен изменить значение, но и даже знак.
Вопрос о направленности реакции решается в рамках второго постулата термодинамики, согласно которому запрещено полное, без потерь превращение тепла в работу. Перенос тепла возможен только от горячего к холодному, не наоборот:
DH = DG + (DH)¢,
где DG – полезное тепло, изменение энергии Гиббса, а второй член – неизбежные потери тепла. Показано, что это «бесполезное» тепло связано с изменением функции состояния системы, называемой энтропией.
(DH)¢ = Т DS
Энтропия (S) – мера неупорядоченности (беспорядка) системы.
DG = DH - Т DS.
Понятие «беспорядок» связано с числом способов осуществления данного состояния, при переходе от кристалла к жидкости и пару беспорядок системы растет, особенно в газовой фазе, где молекулы двигаются хаотично, беспорядочно. Энтропия одного моля газа примерно составляет 200-250 Дж/моль·град. Знак изменения энтропии в химической реакции может быть оценен при сравнении числа газовых молей в левой и правой частях уравнения. Расчет изменения энтропии аналогичен расчету изменения энтальпии химической реакции, только следует учитывать как сложные, так и простые вещества:
DS = S nj SоBj - S ni SоАi.
j i
Энтропия идеального кристалла при Т=0К равна нулю, это начало отсчета. Увеличение энтропии всегда выгодный, самопроизвольно протекающий процесс, как и снижение энергии системы. Оба всеобщих принципа минимума энергии и роста энтропии совмещены в выражении второго начала термодинамики. Рассмотрим возможные варианты энтальпийного и энтропийного вкладов в изменение энергии Гиббса.
1. Экзотермический процесс с увеличением энтропии. DH<0, DS>0.
KCIO3 ® KCI + 3/2 O2
Вне зависимости от температуры, при "Т DG<0, это необходимое условие необратимого процесса слева направо.
2. Эндотермический процесс с уменьшением температуры, DH>0, DS<0.
Вне зависимости от температуры, при "Т DG>0, это необходимое условие запрета процесса слева направо. Не может быть таких физических условий, при которых бы хлорид калия прореагировал с кислородом с образованием бертолетовой соли.
3. DH<0, DS<0 или DH>0, DS>0. Один фактор способствует протеканию реакции, а другой препятствует. В этом случае неизбежно существует такая равновесная температура Травн, при которой DG=0. Это условие равновесия, обратимой химической реакции, которая разрешена и слева направо и наоборот – справа налево.
0= DG = DH - Травн DS,
откуда значение Травн = DH/DS.
Например, при какой температуре установится равновесие в гомогенной газовой системе Н2 + 1/2О2 «Н2О?
DHоН2О (газ) = - 241,84 кДж/моль, SоН2О (газ) = 188,74 Дж/моль·K
SоO2 (газ) = 205 Дж/моль·K, SоH2 (газ) = 130,6 Дж/моль·K, DHоН2 =DHоО2=0
DH=DHоН2О (газ) = - 241,84 кДж/моль.
DS= SоН2О (газ) - SоH2 (газ) - 1/2 SоO2 (газ) = 188,74 - 130,6 - 102,5
= - 44,36Дж/моль·K = - 0,044 кДж/моль·K
Травн = DH/DS = - 241,84/- 0,044 = 5500K
DG = DH - Т DS
При Т<5500К для прямой реакции DG<0 и этот процесс разрешен, водород горит в кислороде с образованием воды; при Т>5500К прямой процесс запрещен: DG>0, протекает обратная реакция термической диссоциации воды. При 5500К состояние равновесия. Особенности этого состояния будут подробно рассмотрены на следующей лекции.
Термодинамическое разрешающее условие DG<0 является необходимым, но не достаточным. Должны быть созданы условия для протекания процесса с заметной скоростью.
uср = DС/Dt Скорость реакции – изменение концентрации за единицу времени.
u = ± dC/dt – первая производная концентрации по времени.
Для реакции А ® В DСА = С2 – С1 < 0, поэтому производная со знаком «минус», иначе получится отрицательная скорость. При использовании концентраций продуктов реакции (В) производная со знаком «плюс».
Изменение концентраций веществ А и В графически можно представить следующим образом:
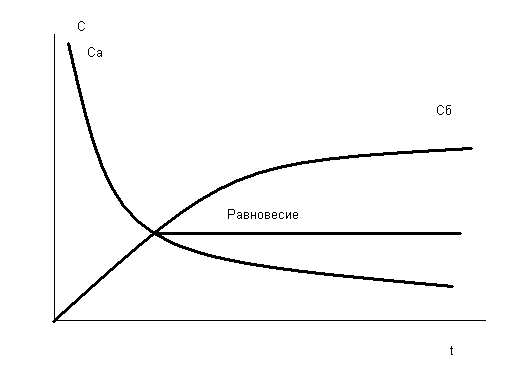
Рис.2.1 Скорости прямой и обратной реакций во времени
Скорость реакции зависит от ряда факторов, прежде всего от концентраций реагирующих веществ. Пусть в газовой фазе протекает реакция между веществами А и В с образованием продукта АВ. В любой фиксированной точке пространства молекулы А могут оказаться с какой-то вероятностью Р(А). В этой же точке могут оказаться молекулы В с вероятностью Р(В). Химическая реакция возможна между А и В только при соударении молекул, пусть вероятность этого события будет Р(АВ). Соударение – событие совместное, вероятность равна произведению вероятностей (при несовместном событии – суммация):
Р(АВ) = Р(А) · Р(В).
Левая часть уравнения пропорциональна скорости реакции, а вероятности Р(А) и Р(В) прямо пропорциональны концентрациям веществ А и В, для перехода от пропорциональности к равенству введем коэффициент пропорциональности к – константу скорости:
u = к СА · СВ
Физический смысл к: к=u при СА = СВ = 1 моль/л. Если в реакции принимают участие m молей А n молей В, выражение для скорости реакции принимает вид:
u = к САm · СВn.
Сумму показателей степеней называют порядком реакции. Полученное уравнение является одним из основных в кинетике реакций, это закон действия масс. Вероятность соударения трех и более молекул минимальна и быстро падает до нуля, поэтому любая химическая реакция протекает не сразу, а в несколько стадий. На каждой стадии сталкиваются две, максимум три молекулы. Совокупность стадий химической реакции называется ее механизмом. Самая медленная стадия называется лимитирующей (контролирующей, определяющей). Скорость реакции в целом определяется скоростью лимитирующей стадии.
Решающее влияние на скорость реакции оказывает изменение температуры. Температурная зависимость скорости реакции выражается правилом Вант - Гоффа: при увеличении температуры на 10о скорость реакции возрастает в 2-4 раза. При охлаждении происходит снижение скорости в такое же число раз:
u Т+DТ / uТ = g DТ/10
где g - температурный коэффициент реакции равный 2-4.
В чем заключается причина такого сильного влияния температуры на скорость реакции? Ведь при увеличении на 100о при g=3 скорость увеличится в 310 раз! Общее число соударений между молекулами в газовой фазе при этом возрастает всего в 1,2 раза, это доказано в молекулярно-кинетической теории газов.
Дело заключается в том, что исходные вещества, если они существуют сами по себе, то есть стабильны, не могут превратиться в продукты реакции без начальных затрат энергии, необходимо преодолеть энергию межэлектронного отталкивания при соударении молекул. Этот энергетический барьер на пути реакции называется энергией активации – минимальная энергия, которую необходимо затратить, чтобы началась химическая реакция.
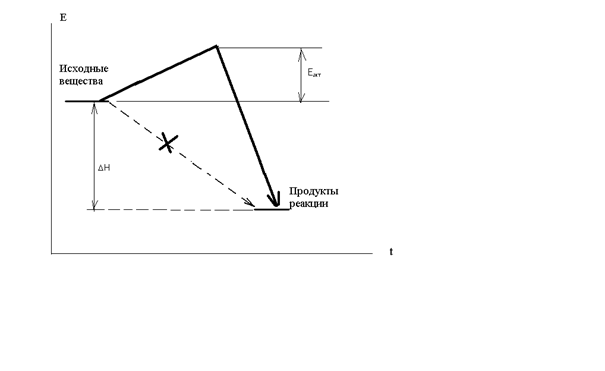
Рис.2.2 Энергия активации реакции
DН – изменение энтальпии, рассмотрен случай экзотермической реакции, Еакт – энергия активации. Кинетическая энергия сталкивающихся молекул может быть меньше величины энергии активации и тогда реакция невозможна, соударении неэффективно. Переход в продукты реакции возможен только в противоположном случае, когда энергия соударения превышает активационный барьер (эффективное соударение). С ростом температуры растет скорость движения молекул, их кинетическая энергия – еще в большей степени (mu2/2), поэтому сильно возрастает доля эффективных соударений в общем числе и, соответственно, скорость реакции. Нагреванием можно «разогнать» реакцию даже вплоть до взрыва, а при снижении температуры реакцию можно остановить, «заморозить».
В случае гетерогенной системы реакция протекает на поверхности твердой фазы и ее скорость будет существенно зависеть от величины поверхности. Например, скорость выделения водорода из кислоты на металлическом порошке гораздо больше, чем на отдельной грануле.
Скорость химической реакции можно существенно увеличить добавлением в систему катализатора. В случае гомогенного катализа (участники реакции и катализатор в одной фазе) изменяется механизм процесса в сторону снижения энергии активации, например, реакция окисления сернистого газа кислородом:
SO2 + O2 = SO3 Еакт
катализируется диоксидом азота.
1. SO2 + NO2 = SO3 + NO Еакт’
2. NO + O2 = NO2 Еакт”
при этом Еакт’ << Еакт и Еакт” << Еакт.
В гетерогенном катализе реакция будет протекать на поверхности катализатора. При этом за счет адсорбции увеличена концентрация исходных веществ, химические связи в которых ослаблены за счет образования промежуточных соединений. Таковы основные закономерности кинетики химической реакции.
Чаще химическая реакция обратима, когда имеет одинаковые знаки изменения энтальпии и энтропии. Рассмотрим подробнее свойства состояния равновесия.
Во-первых, химическое равновесие устойчиво, то есть система будет пребывать в состоянии равновесия сколь угодно длительное время при поддержании постоянных внешних условий.
Во-вторых, химическое равновесие подвижно. Если изменить одно из условий, при которых система находится в равновесии, например, температуру, давление или концентрацию, то равновесие сместится в направлении реакции, которая противодействует этому изменению (при прочих равных условиях) – это принцип Ле-Шателье.
(PCI5) «(PCI3) + (CI2) DH>0, DS>0.
При увеличении температуры это равновесие смещается вправо, в сторону реакции с поглощением тепла. При увеличении давления равновесие смещается влево, в сторону реакции с уменьшением давления. При уменьшении концентрации хлора равновесие смещается вправо, в сторону реакции с увеличением этой концентрации. Так обратимый процесс можно довести практически до конца. Реакция системы направлена на компенсацию возмущающего действия, в сторону возврата в состояние равновесия. В живом организме одновременно протекает много процессов, это более сложная система и в этом случае говорят не о равновесии, а о гомеостазе – способности живого организма к саморегуляции при изменении условий окружающей среды.
И, в третьих, химическое равновесие имеет динамический характер. Химические реакции не остановлены, и прямой, и обратный процессы продолжают протекать, но без видимых изменений.
Пусть uпр – скорость прямой реакции, а uобр – скорость обратной реакции в обратимой системе
mA + nB «pC qD.
uпр = Kпр СAm CBn, а uобр = Kобр ССp CDq.
Кривые uпр и uобр (Са и Сб на рис.2.1 для реакции А → В) расположены таким образом, что в какой-то момент времени пересекаются и далее состоянию равновесия соответствует линия, параллельная оси времени, при этом выполняется кинетическое условие равновесия – равенство скоростей прямой и обратной реакций:
uпр = uобр
Kпр СAm CBn = Kобр ССp CDq.
Приводим равенство к виду:
ССp CDq / СAm CBn = Kпр / Kобр. Отношение констант скоростей реакций не зависит от концентраций, это также константа при данной температуре, обозначим ее Кс – константой химического равновесия. В случае газообразных веществ удобнее пользоваться не концентрациями, а парциальными давлениями компонентов системы.
ССp CDq / СAm CBn = Кс;
РСp РDq / РAm РBn = Кр.
Константа равновесия – постоянная при данной температуре величина, которая определяет соотношение концентраций (парциальных давлений) всех веществ – участников равновесия.
Изменим (увеличим концентрацию вещества С), тогда все концентрации изменят значения таким образом, чтобы константа равновесия сохранила свое постоянное значение. Вещество С в знаменателе, значит, возрастут концентрации веществ А и В в числителе, равновесие смещается влево в сторону обратной реакции (по принципу Ле-Шателье).
Например, для гомогенной газовой системы:
2(Н2) + (О2) «2(Н2О)
выражение для константы равновесия Кр может быть записано в виде:
Кр = Р2Н2О /P2H2• PO2, а для гетерогенной реакции:
[CaCO3] «[CaO] + (CO2)
Кр = PCO2,
потому что твердые вещества оксид и карбонат кальция являются фазами постоянного состава, их концентрации не изменяются и как постоянные величины автоматически включаются в константу равновесия.
Фазовые равновесия имеют названия, если речь идет о превращении твердого вещества X в жидкость, то это плавление:
[X] «{X}.
[X] «(X) – это равновесие сублимации,
{X}«(X) – а это равновесие испарения.
В химической термодинамике показано, что константа химического равновесия прямо связана со стандартным изменением энергии Гиббса:
ΔGo = – RTlnK = ΔHo – TΔSo, где R – газовая постоянная.
Например, для равновесия сублимации Кр = Рx,
– RTln Рx = ΔHo – TΔSo.
Решаем относительно Рx:
Рx = exp(ΔSo/R – ΔHo/ RT)
На рис.2.3 представлен график температурной зависимости давления от температуры.

Рис.2.3 Давление пара вещества
1 – область насыщенного пара;
2 – область ненасыщенного пара
Давление пара вещества развивается по экспоненте – это область насыщенного пара (1), когда пар находится в равновесии с твердой фазой. После перехода в пар всего вещества наступает область гомогенного газового равновесия, то есть область ненасыщенного пара (2). Здесь давление развивается по прямой термического расширения идеального газа в соответствии с уравнением состояния идеального газа Менделеева-Клапейрона:
PV = mRT/M,
где m – масса газа, М – молекулярная масса. Газовая постоянная R= 0,082 л•атм/ моль•К = 62400 мл• мм Hg/ моль•К. Представления о газовом состоянии окажутся полезными далее в теории растворов. Растворы, прежде всего водные системы, представляют для нас особый интерес.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1235; Нарушение авторских прав?; Мы поможем в написании вашей работы!