
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 6. Электродный потенциал металла
|
|
|
|
Переходим к системам, состоящим из растворов электролитов и металлов. Такие системы называются электродами, в них либо получается электрический ток в результате химических реакций, либо под действием тока на электродах развиваются химические процессы. Эта лекция центральная, главная для всего курса, в ней будут сформулированы новые понятия, используемые далее во всех лекциях.
Пусть М – любой металл, а «|» - его поверхность, то есть граница раздела фаз металл-раствор. Например, металл погружен в раствор собственной соли, содержащий ионы Мn+. Металл, погруженный в раствор своей соли, называется электродом 1рода: M|Мn+. В такой системе возможны следующие реакции на поверхности металла:
M ─ ne → Мn+ -окисление металла;
Мn+ + ne → M – восстановление катиона металла.
Если нет раствора, а вакуум, речь может идти об испарении металла, это высокотемпературный процесс, при обычной температуре только ртуть имеет заметное давление пара и может испаряться. В случае водного раствора молекулы воды вступают с катионом металла в химическую реакцию гидратации, а это выгодный экзотермический процесс, который может оказать существенное влияние на возможность процесса растворения металла в растворе электролита уже при обычных температурах.
Кристаллическая структура любого металла представляется в виде атомов (M) и ионов (Мn+):
M M Мn+ M Мn+
• • • • • • • •
M Мn+ M Мn+ M
Все металлы – восстановители, способны отдавать электроны. Эти электроны не «привязаны» к своему атому металла, они свободны, общие (• • • •). Получается структура, называемая атом-ион: M• Мn+ • ne. С ней связаны основные металлические свойства, а именно способность проводить электрический ток, тепло, иметь металлический блеск.
Работа переноса единицы электрического заряда (электрона) из бесконечности в данную точку называется электрическим потенциалом. Потенциал не может иметь абсолютных значений, это работа, энергия. Мы всегда оперируем понятием разности потенциалов. Работа переноса электрона в разных средах различна. В нашем случае на границе раздела металл – раствор эта работа резко, скачкообразно изменит свое значение при переходе из одной фазы в другую. Сочетание таких фаз есть электродная система, поэтому скачок потенциала на границе раздела фаз металл – раствор электролита называется электродным потенциалом металла (ε). Рассмотрим подробнее механизм процессов на поверхности металла.
Процесс разрушения кристаллической структуры металла с выходом иона металла в раствор характеризуется величиной работы выхода иона – Авых. Это положительная, эндотермическая величина, зависящая от прочности решетки металла. После выхода иона металла в раствор происходит экзотермический процесс его гидратации с величиной энтальпии ΔНгидр. Для большинства металлов вторая величина больше первой по абсолютной величине:
1. М= Mg, AI, Zn, Fe, Cr, Ni, Co и др. |Авых| / |ΔНгидр| < 1
Работа выхода иона является энергией активации процесса растворения металла в растворе. Рассмотрим процесс на диаграмме, где по оси ординат – энергия, параллельная этой оси пунктирная линия – поверхность металла, а ось X – координата от поверхности металла в раствор (рис.6.1). Кривая «акl» – характеризует процесс перехода первого катиона металла из металлической фазы в раствор. Процесс вероятен, потому что при гидратации энергии выделяется больше, чем поглощается. Отрыв первого катиона происходит от нейтральной поверхности металла. Как только положительно заряженный ион металла уходит в раствор, на металле образуется избыток электронов и соответствующий отрицательный заряд n─. Вырвать второй положительно заряженный ион металла от отрицательно заряженной поверхности уже несколько сложнее, вероятность падает с отрывом каждого последующего катиона, процесс тормозится, а вероятность обратного процесса осаждения катиона из раствора на металл растет. Точка «а» постепенно опускается вниз, а точка «l» - смещается вверх. Имеет место тенденция к выравниванию скоростей прямой и обратной реакции, то есть к достижению состояния равновесия, когда скорость окисления металла равна скорости восстановления его ионов: v окисл = v восст:
M ─ ne ↔ Mn+, окисление металла, v окисл;
Mn+ + ne ↔ M, восстановление катионов металла, v восст.
Равновесная кривая - «Ар Kр Lр», процесс равновероятен как справа налево, так и наоборот.
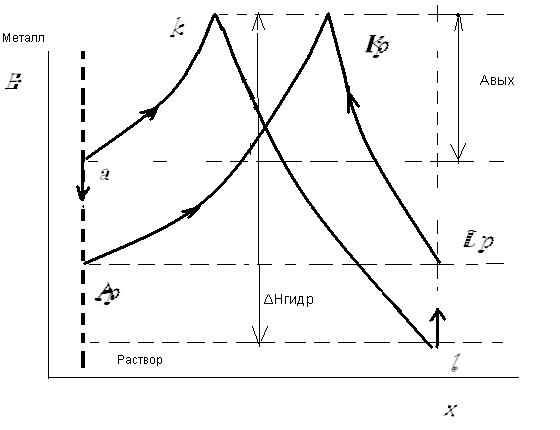
Рис.6.1 Механизм электродных реакций
Например, на цинковом электроде, представляющем собой цинковую пластину, погруженную в раствор соли цинка, достигается равновесие:
Zn ─ 2e «Zn 2+.
Подход к этому равновесию начинался со стороны реакции окисления (цинк в первой группе металлов, о которой идет речь), поэтому цинк и другие металлы первой группы заряжены отрицательно относительно раствора своей соли (рис.6.2).
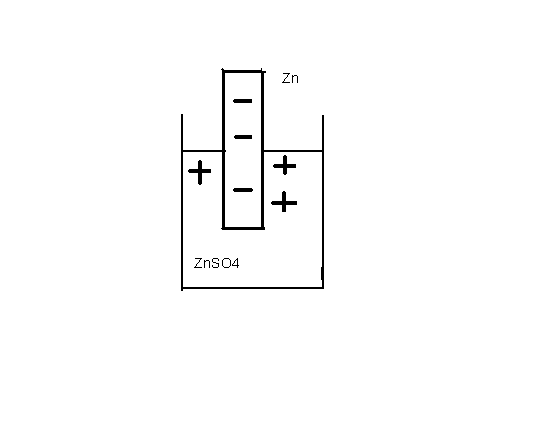
Рис.6.2 Цинковый электрод
Вторая группа металлов М = Cu, Ag, Au, Pt и др. Для этих металлов характерна прочная кристаллическая решетка с большой величиной работы выхода иона: |Авых| / |ΔНгидр| > 1. Реакция окисления, то есть растворения металла маловероятна, процесс начинается с другой стороны, с восстановления катионов металла из раствора. Первый катион восстанавливается легко, второй уже несколько хуже и т.д. Вероятность окисления постепенно возрастает, в конечном счете наступит состояние равновесия, но с другой стороны. Металлы этой группы будут заряжены положительно относительно раствора своей соли, как это показано на рис.6.3 на примере меди: Cu2+ + 2e «Cu.
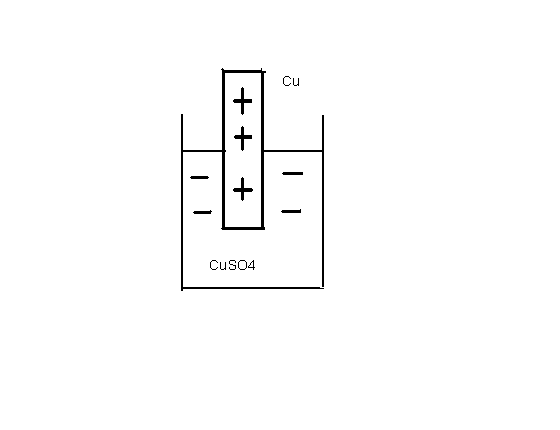
Рис.6.3 Медный электрод
Распределение катионов металла в растворе имеет определенный характер, большая часть из них остается в непосредственной близости от поверхности электрода, например, положительно заряженные ионы цинка «зависают» в непосредственной близости отрицательно заряженной поверхности металлического цинка (плотный слой катионов). Только небольшая их часть диффундирует по всему объему раствора соли цинка (диффузный слой катионов). Эта конструкция называется двойной электрический слой. Скачок потенциала происходит главным образом за счет плотного слоя, где сосредоточена основная масса зарядов: Δ ε = Δ εпл + Δ εдиф, причем Δ εпл » Δ εдиф.
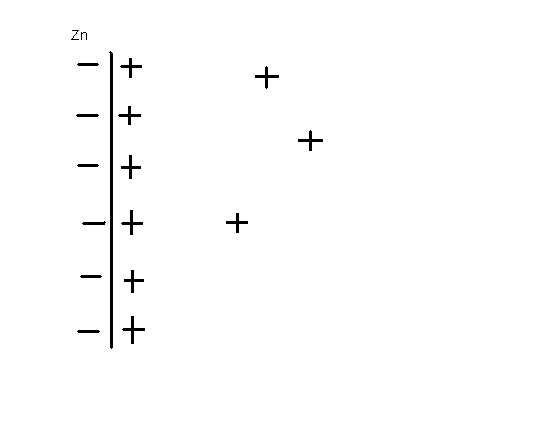
Рис.6.4 Двойной электрический слой
Рассмотрим подробнее состояние равновесия в системе:
M ─ ne «Mn+.
Необходимо отметить два условия достижения такого равновесия, во первых, металл должен быть обязательно погружен в раствор собственной соли. Это материальное условие равновесия. Во-вторых, должно выполняться кинетическое условие, то есть условие равенства скоростей прямой и обратной реакций v окисл = v восст. Электродный потенциал металла в растворе собственной соли в состоянии равновесия называется равновесным потенциалом ( εр ).
Запишем выражение для константы этого равновесия:
K = CMn+ / CM.
Равновесный потенциал должен зависеть от природы металла и от концентрации иона металла в растворе. Изменение энергии Гиббса реакции окисления металла есть полезная работа, а в нашем случае речь идее об электродном потенциале, то есть работе переноса единицы электрического заряда. При стандартных условиях и при перемещении n единиц электрического заряда (число электронов):
ΔGo = ─ εр •n • F,
где F – константа Фарадея для приведения энергии к молю. С другой стороны, стандартное изменение энергии Гиббса связано с константой равновесия:
ΔGo = ─ RT lnK = ─ RT lnCMn+ / CM,
─ εр n F = ─ RT lnCMn+ / CM,
εр = ─ RT lnCM/nF + (RT/nF) •lnCMn+.
Первый член включает только постоянные величины, в том числе CM = const, твердый металл есть фаза постоянного состава. Обозначим этот член при стандартной температуре 298К как ─ RT lnCM/nF = εо, тогда уравнение примет вид:
εр = εо + (RT/nF) •lnCMn+.
Оно выражает зависимость равновесного электродного потенциала от природы металла и его концентрации, называется уравнением Нернста. Для его практического использования подставим значения констант и перейдем к десятичным логарифмам:
εр = εо + (0,059/n) •lgCMn+.
При стандартных условиях, в том числе при стандартной концентрации иона металла в растворе CMn+ = 1 моль/л, логарифмический член lgCMn+=0 и:
εр = εо – стандартный электродный потенциал металла.
Ряд металлов, расположенных по возрастающей величине стандартного электродного потенциала, называют рядом напряжений (или рядом активности металлов). Этот ряд представлен в таблице 6.1. Речь идет о главной электрохимической характеристике металла. Позднее будет показано, каким образом получены эти величины, ведь электродный потенциал не имеет абсолютных значений.
Таблица 6.1
Стандартные электродные потенциалы металлов (Ряд напряжений)
| Металл | Электродная реакция | εо, В |
| Li | Li+ + e «Li | ─ 3,045 |
| Ca | Ca2+ + 2e «Ca | ─ 2,87 |
| Na | Na+ + e «Na | ─ 2,71 |
| Mg | Mg2+ + 2e «Mg | ─ 2,37 |
| AI | AI3+ + 3e «AI | ─ 1,66 |
| Ti | Ti2+ + 2e «Ti | ─ 1,63 |
| Mn | Mn2+ + 2e «Mn | ─ 1,18 |
| Zn | Zn2+ + 2e «Zn | ─ 0,762 |
| Cr | Cr3+ + 3e «Cr | ─ 0,74 |
| Fe | Fe2+ + 2e «Fe | ─ 0,44 |
| Ni | Ni2+ + 2e «Ni | ─ 0,25 |
| Sn | Sn2+ + 2e «Sn | ─ 0,136 |
| Pb | Pb2+ + 2e «Pb | ─ 0,126 |
| H2 | 2H+ + 2e «H2 | |
| Cu | Cu2+ + 2e «Cu | + 0,337 |
| Ag | Ag+ + e «Ag | + 0,799 |
| Pt | Pt3+ + 3e «Pt | + 1,19 |
| Au | Au3+ + 3e «Au | + 1,50 |
Самые низкие потенциалы имеют активные металлы, наиболее сильные восстановители – это щелочные и щелочноземельные металлы. В другом конце ряда напряжений находятся самые инертные (благородные) металлы. Они плохие восстановители, но их ионы – достаточно сильные окислители. (См выше о металлах первой и второй группы).
Металл в растворе своей соли – сравнительно редкий случай, чаще металл погружен в водную среду, не содержащую ионов этого металла, например цинк в морской воде. Нарушается материальное условие равновесия, такой потенциал металла называется неравновесным или коррозионным – εнр. В этом случае процессы окисления и восстановления разные:
Zn ─ 2e → Zn2+ - окисление цинка.
O2 + 2H2O + 4e → 4OH─ - восстановление кислорода.
Реакции разные, но они могут протекать с одинаковыми скоростями, то есть выполняется кинетическое условие равновесия. Потенциал цинка в морской воде неравновесный, но он имеет определенное значение, его можно измерить, он устойчив во времени – это стационарный потенциал - εнрс. εсZn/мор.вода= ─ 0,8В.
Наконец, в последнем случае, когда нарушено и материальное условие и кинетическое, потенциал нестабилен во времени, не имеет определенного значения – это неравновесный нестационарный потенциал - εнр нс.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1817; Нарушение авторских прав?; Мы поможем в написании вашей работы!