
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поляризация электродов
|
|
|
|
Семестр. Лекция 8
Химические источники тока нашли еще более широкое применение, если бы удалось преодолеть их главный недостаток – нестабильность во времени значений потенциалов электродов. Состояние равновесия возможно только при отсутствии тока в цепи. В зависимости от величины тока эти потенциалы «съезжают» от своих исходных равновесных значений.
Смещение потенциала электрода от исходного равновесного или стационарного значения называется поляризацией электрода. Изменение во времени потенциала анода – анодная поляризация (Δ εа ). При этом потенциал анода смещается в положительную сторону от исходного значения. Потенциал катода вследствие катодной поляризации (Δ εк ) смещается в отрицательную сторону от своего начального значения. Потенциалы электродов сближают значения разность потенциалов (э.д.с.) снижается и в конечном счете стремится к нулю:
Е = εк ─ εа → 0.
При Е =0 происходит прекращение работы гальванического элемента, это состояние полной поляризации.
Основных причин нестабильности значений потенциалов две. Первая связана с медленным протеканием процессов диффузии ионов в растворе электролита – это так называемая концентрационная поляризация. Вторая причина химическая, это замедление работы из-за кинетических проблем у самой электродной реакции окисления или восстановления. Такую поляризацию называют электрохимической или перенапряжением (η).
Выше на рис.6.4 изображен двойной электрический слой на цинковом электроде (аноде). Хорошо видно, что катионы цинка притягиваются к отрицательно заряженной поверхности цинка и «зависают» на ней, мешают следующим катионам выходить из металла в раствор и диффундировать по всему объему электролита. Катионы цинка на поверхности электрода гасят его отрицательный заряд, и тем самым потенциал смещается в положительную сторону. На катоде все наоборот. Катионы металла из объема раствора должны диффундировать к поверхности катода и восстанавливаться на ней. Эта диффузия не может протекать достаточно быстро, подвижность катионов металлов (см. рис.3.1) в растворе ограничена из-за большой гидратной «шубы», они не успевают подходить к поверхности катода в требуемом количестве, а потенциал смещается в отрицательную сторону.
Для снижения последствий концентрационной поляризации необходимо «заставить» ионы перемещаться быстрее, для этого раствор можно нагреть или перемешивать. Известно, что для восстановления работы сухого элемента требуется постучать по нему. Происходит смещение, частичное перемешивание электролита, поляризация устраняется, хотя и не надолго. Надежность работы батарейки определяется величиной тока. Чем меньше ток, тем поляризация меньше и элемент работает дольше (аккумулятор телефона в режиме ожидания). При увеличении силы тока электроды поляризуются очень сильно. Все основные усилия компаний-производителей химических источников тока направлены на решение проблемы снижения поляризуемости электродов, здесь все имеет значение – состояние поверхности электрода, его форма, состав электролита и т.д.
Процессы электролиза
Представим себе теперь противоположный случай двухэлектродной системы, в которой под действием электрической энергии в растворе или расплаве электролита происходят окислительно-восстановительные реакции – процессы электролиза. Если воспользоваться сетью переменного тока, электроэнергия превращается только в тепло. Для электролиза необходим источник постоянного тока. Кроме того, нужна ванна с электролитом, называемая электролизером и два электрода. Важно то, из какого материала изготавливается анод. На аноде (при электролизе это положительно заряженный электрод) протекает процесс окисления. Большинство металлических материалов окисляются под действие электрического тока, материал катода особого значения не имеет. На этом электроде происходит реакция восстановления и необходимо лишь его способность проводить ток. Например, рассмотрим процесс электролиза раствора сернокислого цинка. В качестве анода используем металлический цинк, а в роли катода – медную пластину. Схема установки представлена на рис.8.1.
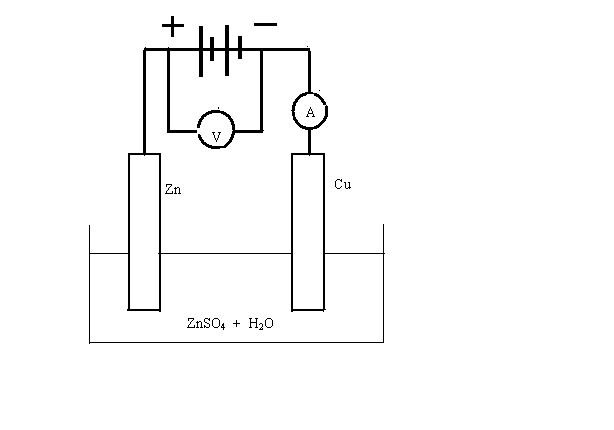
Рис.8.1 Электролиз раствора сульфата цинка
Под действие электрического тока на цинковом аноде начнется реакция его окисления, материал анода растворяется. Такие аноды так и называют растворимыми:
(+) Zn ─ 2e ↔ Zn2+.
Катионы цинка, имеющиеся в растворе при диссоциации сульфата, диффундируют к поверхности отрицательно заряженного катода и восстанавливаются на нем:
( ─ ) Zn2+ +2e ↔ Zn ↓.
На поверхности меди образуется слой металлического цинка. Процесс называют гальваническим цинкованием, так на металл можно нанести слой или слои других металлов с целью защиты от коррозии или для улучшения внешнего вида изделия. Процесс используется также на предприятиях цветной металлургии. В результате металлургических операций полученные металлические медь, никель, кобальт загрязнены другими металлами, серой. Окончательная очистка проводится в цехах электролиза. Изделия погружаются в ванны и выполняют роль растворимого анода, на катоде осаждается только нужный чистый металл. Электролитической очисткой получают катодную медь, никель, кобальт.
Как и в гальваническом элементе, электроды при электролизе поляризуются. Потенциал анода во времени растет (а он заряжен положительно), потенциал катода снижается (этот электрод заряжен отрицательно). Минимальная разность потенциалов внешнего источника тока, при которой начинается процесс электролиза, называется потенциалом разложения электролита. Процесс начинается, но в результате поляризации разность потенциалов становится больше, и процесс останавливается, необходимо увеличивать разность потенциалов, но в конечном счете опять произойдет остановка. Результат – перерасход электроэнергии. Для снижения концентрационной поляризации электролит в ваннах нагревают практически до кипения (!). Соли тяжелых металлов механически в больших количествах попадают в атмосферу цеха электролиза. Это одно из самых вредных производств.
Электролиз проводят и в расплаве электролита, например при получении металлического алюминия. В этом случае ванна – это высокотемпературная печь для получения расплава. Допустим, в электролизер загружен расплав хлорида никеля, а в качестве анода использован графит, инертный по отношению к окислению электрическим током материал. Такой процесс называют электролизом с нерастворимым (инертным) анодом. На поверхности графита будет окисляться анион хлора, имеющийся в расплаве при диссоциации соли. Катион никеля будет восстанавливаться на катоде:
NiCI2 ↔ Ni2+ + 2CI─;
(+) 2CI─ ─ 2e ↔ CI2 ↑
( ─ ) Ni2+ + 2e ↔ Ni ↓.
Случай электролиза раствора сложнее в сравнении с расплавом, потому что электролизу может подвергаться и сама вода. Под действием электрического тока она разлагается на газообразные водород и кислород. Обсудим все возможные конкурирующие процессы при электролизе растворов электролитов.
1. Анодные процессы.
1.1 Анод растворимый. Материал анода М= Mg, AI, Zn, Fe, Mn, Cr, Sn и др.:
(+) M ─ ne ↔ Mn+.
1.2 Анод инертный (графит, Pt, Ti, Nb).
Возможны варианты. Все анионы можно разделить на две группы. В первую относятся анионы бескислородсодержащих кислот типа CI─, Br─, I─, S2─. Эти анионы окисляются легко:
(+) 2CI─ ─ 2e ↔ CI2 ↑
(+) 2Br─ ─ 2e ↔ Br2
(+) S2─ ─ 2e ↔ S↓.
Во вторую группу относят сложные анионы с кислородом типа сульфатного SO42─, карбонатного CO32─, фосфатного PO43─, нитратного NO3─ и др. У этих анионов высокий потенциал окисления, больше, чем у воды, поэтому происходит процесс окисления молекулы воды. В щелочной среде высокая концентрация гидроксидных анионов, которые окисляются также легко. В зависимости от рН:
(+) 2H2O ─ 4e ↔ O2↑ + 4H+ при рН ≤ 7
(+) 4OH─ ─ 4e ↔ O2↑ + 2H2O при рН > 7.
2. Катодные процессы.
На этом электроде конкурируют два процесса восстановления:
( ─ ) Mn+ + ne ↔ M↓.
( ─ ) 2H+ + 2e ↔ H2↑.
Чем больше электродный потенциал, тем легче происходит восстановление на катоде. Получается, что электролизом можно получить только металлы с положительными значениями стандартных электродных потенциалов, так как у водорода εоН2 = 0 (см. табл.6.1). на самом деле восстанавливаются катионы свинца, олова, никеля, железа, цинка, и только в случае очень активных металлов на катоде выделяется водород. Рассмотрим механизм реакции восстановления водорода на катоде:
2H+ + 2e ↔ H2↑
Эта, казалось бы, простая реакция протекает совсем не просто, у нее пятистадийный механизм:
а) диффузия гидратированных ионов водорода к поверхности электрода из объема электролита;
б) стадия дегидратации Н3О+ → Н+ + Н2О;
в) стадия разряда H+ + e → H;
г) стадия рекомбинации (образования молекул) H + H → H2;
д) стадия образования пузырьков газообразного водорода, покидающих его поверхность – H2↑. Только теперь можно считать процесс законченным.
Следствием такого сложного механизма является торможение процесса в целом, его невозможности протекать быстро и гладко без препятствий, иными словами речь идет о катодной электрохимической поляризации. В электрохимии создано две основных теории водородного перенапряжения. В теории замедленного разряда предполагается, что лимитирующей стадией процесса является стадия «в», а в теории замедленной рекомбинации – стадия «г». Вывод этих теорий по величине перенапряжения совпадает: ηH2 = 1,7В. От величины равновесного (стандартного) потенциала водорода нужно сместиться в отрицательную сторону (процесс катодный) на величину 1,7В (см. табл.6.1). Попадаем на алюминий. С учетом перенапряжения реакции восстановления водорода на катоде он оказывается на месте алюминия, совсем в другой области ряда напряжений. У всех металлов, расположенных в ряду ниже алюминия, потенциал оказывается больше, чем у водорода. Такие металлы и восстанавливаются на катоде:
( ─ ) Mn+ + ne ↔ M↓. при условии εом > εоAI
( ─ ) 2H+ + 2e ↔ H2↑ при условии εом ≤ εоAI и при рН <7.
Ионы водорода в больших концентрациях есть в кислой среде, в нейтральной или щелочной среде с выделением водорода восстанавливается молекула воды:
( ─ ) 2H2O + 2e ↔ H2↑ + 2OH─ при pH ≥ 7.
Продемонстрируем общие закономерности на некоторых примерах.
Электролизу подвергается водный раствор йодистой меди CuI2. Анод инертный (по умолчанию).
Ион иода может окисляться, а ион меди легко восстанавливаться, так как εоCu > εоAI.
(+) 2I─ ─ 2e ↔ I2↓.
( ─ ) Cu2+ + 2e ↔ Cu↓.
Пропускаем электрический ток через раствор фосфата калия K3PO4. Фосфат-ион не окисляется, а катион калия не восстанавливается. Имеет место электролиз воды. Сама вода практически не пропускает электрический ток, поэтому для ее электролиза делают добавки нейтрального по отношению к этому процессу электролита, который сам не подвергается электролизу:
(+) 2H2O ─ 4e ↔ O2↑ + 4H+
( ─ ) 2H2O + 2e ↔ H2↑ + 2OH─.
Имеем раствор бромистоводородной кислоты HBr:
(+) 2Br─ ─ 2e ↔ Br2
( ─ ) 2H+ + 2e ↔ H2↑.
Проводим электролиз раствора гидроксида натрия:
(+) 4OH─ ─ 4e ↔ O2↑ + 2H2O
( ─ ) 2H2O + 2e ↔ H2↑ + 2OH─.
Вместо раствора используем расплавленный гидроксид. Температура расплава выше 100оС, вода улетает из электролизера в виде пара, на катоде образуется металлический натрий. Именно так и получают все активные щелочные, щелочноземельные металлы и алюминий:
(+) 4OH─ ─ 4e ↔ O2↑ + 2H2O↑
( ─ ) Na+ + e ↔ Na.
Для количественного расчета продуктов электролиза используют классический закон Фарадея: одинаковые количества электричества выделяют на электродах при электролизе эквивалентные массы различных веществ.
Один Фарадей электричества выделяет один эквивалент любого вещества. 1F = 96500 Кл (А•с) = 26,8 А•час. Примеры определения эквивалентной массы элементов приведены в лекции 5. Для цинка это (65/2) г/моль, алюминия (27/3) г/моль и т.д. Газы принято измерять в виде объема, а не массы. Для водорода эквивалентная масса 1г/моль, который при нормальных условиях занимает объем 11,2л. Для кислорода 8г/моль или 5,6л. Закон Фарадея можно записать в виде:
m = mэ (I•t/F)
V = Vэ (I•t/F),
uде I – ток,А; t – время электролиза, с,ч; F – число Фарадея, m – масса продукта, г или V – его объем, л.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 7795; Нарушение авторских прав?; Мы поможем в написании вашей работы!