
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 4. Електролізний метод нанесення покрить
|
|
|
|
Лекція 13. ЕЛЕКТРОЛІЗ
13.1. Електроліз у розчинах і розплавах.
Електроліз - сукупність процесів минаючих при проходженні електричного струму через розплав чи розчин електроліту.
При проходженні струму через розплав, наприклад, MgCl2 катіони магнію Mg2+ під дією електричного струму рухаються до негативного електрода. Тут вони взаємодіють з минаючими по зовнішньому ланцюзі електродами - відновлюються.
Mg2+ + 2ē=Mg
Аніони хлору рухаються до позитивного електрода і віддаючи надлишкові електроди, окислюються.
2Cl- = 2Cl + 2ē потім 2Cl → Cl2
Сумарне рівняння буде виглядати
Mg2+ + 2Cl- = Mg + Cl2
Ця реакція не може протікати довільно: енергія для її здійснення надходить від зовнішнього джерела струму. Як і в ХДЕЕ електрод на який відбувається відновлення називається катодом, а електрод на який відбувається окислювання - анодом.
Знаки в катода й анода зворотні тим, що були в ХДЕЕ. При електролізі хімічна реакція здійснюється за рахунок енергії електричного струму,
що пiдводиться ззовні, у той час як при роботі гальванічного елемента енергія хімічної реакції, що відбувається в ньому перетворюється в електричну енергію.
При електролізі розчинів потрібно пам'ятати, що крім іонів електроліту, у кожному водяному розчині маються ще іони води, що розпалася H+ і OH-. У такий спосіб на катоді можуть розряджатися як катіони електроліту так і катіони водню. Аналогічно на аноді може йти як розряд аніонів електроліту, так і іонів гідроксилу.
Розглядаючи катодні процеси потрібно враховувати величину потенціалу процесу відновлення іонів водню. Цей потенціал у випадку нейтральних розчинів (pH=7) дорівнює φ = -0,059 · 7= -0,41В. Якщо електроліт утворений металом, електродний потенціал якого значно позитивнiше -0,41В, то в катоді буде виділятись метал. Такі метали в ряді напруг знаходяться поблизу водню (починаючи з олова і після нього).
Навпаки у випадку електролітів, метал яких має потенціал значно більш негативний чим
-0,41В, метал відновлюватися не буде, а відбудеться виділення водню. До таких металів відносяться метали початку ряду напруг - приблизно до титана включно. Нарешті якщо потенціал металу близький до величини -0,41В (це метали середньої частини ряду - Zn, Cr, Fe, Ca, Nі, Co) то в залежності від концентрацій розчину, можливо як відновлення металу так і виділення водню: нерідко йде спільне виділення металу і водню.
Електрохімічне виділення водню з кислих розчинів відбувається внаслідок розряду іонів водню. У випадку нейтральних чи лужних середовищ воно є результатом електрохімічного відновлення води.
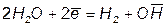
При розгляді анодних процесів варто мати на увазi, що матеріал анода в ході електролізу може окислятися. У зв'язку з цим розрізняють електроліз з інертним анодом і електроліз з активним анодом. Інертним називається анод, що не перетерплює змін у процесі електролізу. Активним називається анод, матеріал якого може окислятися в ході електролізу. Як матеріали для інертних анодів найчастіше використовують: графіт, вугілля, платину. На інертному аноді, при електролізі водяних розчинів лугів, кисневмісних кислот, а також HF і фторидiв відбувається електрохімічне окислювання води з виділенням кисню. У залежності від pH розчину цей процес протікає по-різному і може бути записаний різними рівняннями. У лужному середовищі вони мають вигляд:
4OH- = 2H2O + O2 + 4ē
а у кислому та нейтральному середовищі:
2H2O = O2 + 4H+ + 4ē
Киснемiсткi аніони чи не здатні окислятися чи їхнє окислювання відбувається при дуже високих потенціалах. При електролізі розчинів галогенних кислот (крім HF) HІ, HBr, HCl та їхніх солей в анода виділяється відповідний галоген:
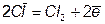
У випадку активного анода можливо: електрохімічне окислювання води з виділенням O2, розряд аніона (тобто окислювання) і електрохімічне окислювання матеріалу анода. З цих трьох буде йти той, котрий хімічно найбільш вигідний.
Якщо метал анода розташований у ряді стандартних напруг раніше обох інших електрохімічних систем, то буде спостерігатися анодне розчинення. У противному випадку буде йти виділення кисню чи розряд аніона.
13.2. Електроліз розчинів при інертному й активному анодах.
Розглянемо електроліз розчину CuCl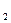 з інертним анодом
з інертним анодом
катод анод
Cu + 2ē = Cu
+ 2ē = Cu 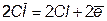
2Cl = Cl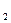
Електроліз розчину NiSO4 з нікелевим анодом.
Стандартний потенціал розчину Nі (-0,250В) трохи більше чим -0,41В, тому при електролізі нейтрального розчину NіSO4 на катоді в основному відбувається розряд іонів Nі2+ і виділення металу. На аноді відбувається зворотний процес - окислювання металу, тому що потенціал Nі набагато менше потенціалу окислювання води
[(2H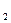 O = O
O = O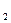 + 4H
+ 4H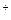 + 2ē) φ
+ 2ē) φ = 1,228В], а тим більше потенціалу окислювання іона SO
= 1,228В], а тим більше потенціалу окислювання іона SO

[( =
=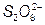 + 2ē) φ
+ 2ē) φ = 2,01В]. Тому в даному випадку електроліз зводиться до розчинення металу на аноді і на виділенню його на катоді
= 2,01В]. Тому в даному випадку електроліз зводиться до розчинення металу на аноді і на виділенню його на катоді
катод NiSO4 анод
 Ni
Ni + 2ē = Ni Ni +
+ 2ē = Ni Ni +  = Ni
= Ni +
+  + 2ē
+ 2ē
Лекція 14. Закони електролізу Фарадея. Поляризація
14.1. Закони Електролізу.
Вивчаючи електроліз англійський фізик Фарадей установив наступні закономірності:
1. Маса утвореної при електролізі речовини пропорційна кількості електрики, що пройшла через розчин. m= KІt, де К – електрохімічний еквівалент
2.
 |

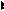





Рис. 14.1
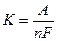
2. При проходженні однакової кількості електрики через розчини різних електролітів, кількість кожного з речовин, що виділилися, пропорційні їхнім хімічним еквівалентам.
H Ag Cu Sn
Маса металу, 1 107,9 31,8 29,7
що видiлилась на катодi, г
Атомна вага металу 1 107,87 63,51 118,69
Водню, що виділився 1 – грам-атом, Ag – 1грам-атом, Cu – ½ грам-атома, Sn – ¼ грам-атома.
До того ж результату приводить і маса речовини, що видiлилась на аноді. т.е. кількість виділюваної речовини пропорційно хімічному еквіваленту, що дорівнює A/n, де А- атомна вага, а n - валентність.
При цьому для виділення 1 грам-еквівалента речовини потрібно затратити заряд рівний 96500 (96487) Кл. Це число називається числом Фарадея і позначається F.
Електролізом розплавів солей одержують метали, що мають сильно негативні електродні потенціали. Унаслідок відсутності води, процеси при електролізі розплавів протікають простіше чим у розчинах. Електролітом служать суміші солей підібрані так, щоб система була легкоплавкою.
Цим методом одержують алюміній, магній, натрій, літій, берилій і кальцій. Цей метод можна також застосувати для одержання цирконію і титана. Електролізом водяних розчинів руд одержують Zn, Cd і Co, а також переробляють бідні марганцеві і хромові руди. Електричному рафінуванню піддають Cu, Nі, Pb, Sn, Ag, Au.
14.2. Електрохімічна поляризація. Перенапруга.
Коли електрод знаходиться при потенціалі, рівному рівноважному, на ньому встановлюється електрохімічна рівновага Red D Ox + 2ē
Якщо прийняти, що за межами прикатодного шару концентрація зберігається постійної і дорівнює С , а в самому шарі міняється лінійно і дорівнює С, то щільність струму на катоді Jk дорівнює:
, а в самому шарі міняється лінійно і дорівнює С, то щільність струму на катоді Jk дорівнює:
 А/см2
А/см2
де Jk – щільність струму на катоді  , А/см2
, А/см2
δ – товщина прикатодного (дифузійного шару) см;
Z – валентність іонів, що розряджаються;
F – число Фарадея (Кл);
D – коефіцієнт дифузії - 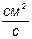 ;
;
При збільшенні щільності струму зменшується концентрація іонів С бiля поверхні катода. У межі, при дуже великій щільності струму концентрація С→0.
Тоді гранична щільність струму при який С=0 буде дорівнювати:
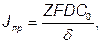 А/см2
А/см2
Зміна потенціалу електрода ∆φ, викликане протіканням струму при дифузійному утрудненні, має вид:
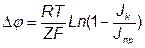 , В
, В
З формули видно, що при малiй щільності струму Jk, близькiй до нуля, величина поляризації також дорівнює нулю. При зростанні щільності струму потенціал катода зрушується в область більш негативних значень. Коли Jk наближається до Jпр то поляризація нескінченно зростає. У дійсності поляризація не буде необмеженої тому що стають можливими інші електрохімічні процеси (розряд інших іонів), що затримує подальшу зміну потенціалу.
При підвищенні температури зростає коефіцієнт дифузії, відповідно зменшується поляризація. При перемішуванні електроліту, конвекції в рідині, а також рух пухирців газу, що утворюються у електродів збільшується гранична щільність струму Jпр, а значить знижується величина поляризації катода.
При зсуві потенціалу електрода в позитивну чи негативну сторону на ньому починають протікати процеси окислювання чи відновлення.
Відхилення потенціалу електрода від його рівноважного значення називається електрохімічною поляризацією чи просто поляризацією.
Розглянемо приклад. Нехай мідний електрод знаходиться в 0,1m розчині CuSo4 не утримуючих ніяких домішок, у тому числі і розчиненому кисні. Поки ланцюг незамкнутий, потенціал електрода буде мати рівноважне значення рівне
φ = 0,337 + 0,03Lg10-1 ≈ 0,31В,
а на границі металу з розчином установиться електрохімічна рівновага
Cu DCu2+ + 2ē.
Підключимо тепер цей електрод до джерела струму зробивши його катодом. Надлишок електронів, що з'являються тепер на електроді, зрушать потенціал електрода в негативну сторону і рівновага порушиться. Електрони будуть притягати катіони міді з розчину - піде процес відновлення
Cu2+ + 2ē = Cu.
Якщо підключити електрод не до негативного, а до позитивного полюса джерела струму - зробити його анодом, то унаслідок видалення частини електронів потенціал електрода зміститься в позитивну сторону і рівновага також порушиться. Але тепер на електроді буде протікати процес окислювання, так як в ході цього процесу звільняються електрони - це анодна поляризація
Cu = Cu2+ + 2ē
Поляризація електрода - необхідна умова протікання електродного процесу. Від її величини залежить швидкість електродного процесу: чим сильніше поляризований електрод, тим з більшою швидкістю протікає на ньому відповідна напівреакція.
Крім величини поляризації на швидкість електродних процесів дуже впливає каталітичний вплив електрода. Так якщо катод виготовлений із платини, то для виділення водню, із заданою швидкістю, необхідна визначена величина катодної поляризації. При заміні платини на срібло (за інших рівних умов) знадобиться велика поляризація, а при заміні Ag на Pb поляризація знадобиться ще більше.
Отже різні метали володіють різною каталітичною активністю стосовно процесу відновлення іонів водню.
Величина поляризації, необхідна для протікання даного електродного процесу з визначеною швидкістю, називається перенапругою даного електродного процесу. У такий спосіб перенапруга виділення водню на різних металах по-різному. Приведемо величини перенапруги для 1н розчину величини катодної поляризації, яку необхідно здійснити на електроді для виділення на ньому водню зі швидкістю 0,1 мл/хв із 1см2 робочої поверхні електрода
Таблиця 14.1
| Метал електроду | Електроліт | Перенапруга В | Метал електроду | Електроліт | Перенапруга В |
| залізо | HCl | 0,5 | цинк | H SO SO
| 1,0 |
| мідь | H SO SO
| 0,6 | ртуть | H SO SO
| 1,2 |
| срібло | HCl | 0,7 | свинець | H SO SO
| 1,3 |
14.3. Вихід по струму.
За законом Фарадея випливає, що якщо через електроліт пропустити 96500Кл електрики, то виділиться 1 грам-еквівалент речовини.
Однак у практиці часто мають місце випадки, коли кількість речовини, що виділилася на катоді (металу), менше розрахованого за законом Фарадея.
Наприклад, якщо пропустити через розчин хромової кислоти (H2CrО4), то на катоді повинний виділитися 1 грам-еквівалент хрому
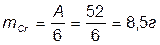
а виділяється в дійсності приблизно в 10 разів менше. Пояснення полягає в тім, що крім основного процесу, на катоді має місце побічний процес - виділення водню. Якщо підрахувати кількість електрики, витраченої на осадження Cr і виділення H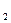 , то одержимо нове підтвердження закону Фарадея.
, то одержимо нове підтвердження закону Фарадея.
| Метал, що осаджується | Атомна вага | Валентність | Електрохімічний еквівалент в г/А-год | Вихід по струму в % | Щільність г/см3 |
| Мідь (з кислого електроліту) | 63,54 | 1,186 | 98 -100 | 8,96 | |
| Мідь (з ціаністого електроліту) | 63,54 | 2,372 | 50 - 80 | 8,96 | |
| Нікель | 58,69 | 1,095 | 95 - 98 | 8,9 | |
| Хром | 52,01 | 0,324 | 10 - 14 | 7,19 | |
| Цинк | 65,38 | 1,220 | 90 - 98 | 7,14 | |
| Олово (з кислого електроліту) | 118,7 | 2,214 | 95 - 98 | 7,3 | |
| Олово (з лужного електроліту) | 118,7 | 1,107 | 70 - 85 | 7,3 | |
| Свинець | 207,21 | 3,865 | 98 - 99 | 11,34 | |
| Срібло | 107,88 | 4,025 | 95 - 99 | 10,5 | |
| Золото | 197,2 | 7,357 | 65 - 75 | 19,32 |
Відношення маси речовини, що виділилася практично, до теоретично обчисленого за законом Фарадея називається виходом по струму.
У випадку хрому вихід по струму в % буде
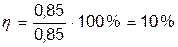
З огляду на вихід по струму закони Фарадея можна записати у виді об'єднаного рівняння
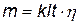 де I – сила струму, t – час в годинах, к – електрохімічний еквівалент, η – вихід по струму.
де I – сила струму, t – час в годинах, к – електрохімічний еквівалент, η – вихід по струму.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 503; Нарушение авторских прав?; Мы поможем в написании вашей работы!