
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественный учет микроорганизмов в силосе
|
|
|
|
Исследование качественного состава микрофлоры силоса
Для анализа из торцевой части траншеи, ямы или наземных буртов берут среднюю пробу силоса. Снявстерильным ножом верхний слой, вырезают кубики по средней линии бурта с интервалом в 1 м. Их складывают в стерильную стеклянную банку на 1—2 л с притертой пробкой так, чтобы силос был уложен плотно и доверху. Пробы перемешивают в стерильном кристаллизаторе, измельчают стерильными ножницами и берут навески для анализов. Исследование проводят не позднее 1 сут после взятия пробы.
Для знакомства с микрофлорой силоса из него готовят препарат. Для этого берут пинцетом немного силоса и плотно прижимают его к предметному стеклу без добавления воды так, чтобы на стекле остался отпечаток. Препарат сушат на воздухе, фиксируют на пламени и окрашивают метиленовым синим (2—3 мин). Смыв краситель водопроводной водой и высушив вдали от пламени, препарат микроскопируют с иммерсионной системой.
На препарате видны тонкие неспорообразующие палочки, варьирующие в размере (молочнокислые бактерии), и молочнокислые лактококки. Среди них обычно преобладают Lactobacillus plantarvm — гомоферментативные мезофильные короткие палочки, часто располагающиеся параллельными рядами. Встречаются клетки почкующихся дрожжей. Спорообразующие бактерии обнаруживаются редко. В некачественном силосе на препарате видны спорообразующие палочки (маслянокислые бактерии, аэробные гнилостные бактерии), а также плесневые грибы.
Навеску силоса (5 г) помещают в колбу с 50 мл стерильной водопроводной воды и 2—3 г песка. Колбу взбалтывают круговыми вращательными движениями 10 мин. Из полученной вытяжки готовят разведения (10-2; 10-3; 10-4; 10-5; 10-6), а затем проводят посев из соответствующих разведений на элективные среды: 1 мл суспензии — при глубинном посеве, 0,05 мл суспензии — при поверхностном. Инкубация при 28°С.
Определение количества молочнокислых бактерий проводят глубинным посевом на сусло-агаре с мелом или на капустном агаре с мелом (среды 1, 1a, см. далее), а также на капустном агаре со спиртом и мелом (среда 2). Вокруг колоний молочнокислых бактерий вследствие накопления молочной кислоты образуются зоны растворения мела (рис. 33).
|
Колонии молочнокислых бактерий на сусло-агаре с мелом и капустном агаре с мелом подсчитывают на 5—6-е сут, а на капустном агаре со спиртом и мелом — на 7—10-е. Среда 2 служит для выявления молочнокислых бактерий в составе эпифитной микрофлоры исходной растительной массы, так как входящим в ее состав спирт тормозит рост посторонней микрофлоры.
Количество посторонней микрофлоры (аэробных гнилостных микроорганизмов) определяют глубинным посевом на пептонном агаре (среда 3). Подсчет колоний ведут на 5—7-е сут.
Количество микроскопических грибов и дрожжей определяют на сусло-агаре со стрептомицином (среда 4) поверхностным посевом. Подсчет колоний ведут на 3—4-е сут, при необходимости повторно — на 7—8-е.
Титр маслянокислых бактерий устанавливают на жидкой среде Емцева (среда 5а) и картофельной среде (среда 5). Для определения количества спор маслянокислых бактерий делают посев из суспензии после ее пастеризации в течение 10 мин при 75°С. Учет ведут по интенсивности выделения газа (кусочки картофеля всплывают), титр маслянокислых бактерий и их спор устанавливают методом предельных разведений по Мак-Креди.
Аэробные и протеолитические бактерии учитывают на МПБ (среда 6) по накоплению газа в поплавках. Посевы выдерживают при 28°С 2 недели.
При анализе силосов из трав, выращенных на фоне высоких доз азотных удобрений, денитрифицирующие бактерии учитывают на среде Гильтая (среда 7). Посевы выдерживают 10—12 дней при 28 °С. Количество денитрификаторов определяют по интенсивности выделения газа и изменению цвета индикатора.
При анализе силоса учитывают также споры аэробных гнилостных бацилл. На плотной с реле (среда 8) делают поверхностный посев. Чашки инкубируют при 28°С, подсчет колоний выполняют на 4-е сут.
Бактерии группы кишечной палочки учитывают на среде Kеccлeра (среда 9) или среде Булера (среда 10) по выделению газа и накоплению его в поплавках. Пробирки выдерживают 48 ч при 40—42°C.
Доминирующие на плотных средах колонии микроскопируют. Для обнаружения маслянокислых бактерий из пробирок с картофелем готовят препарат в раздавленной капле с добавлением раствора Люголя.
Состав элективных сред. Среда 1. Сусло-агар с мелом. Сусло, разбавленное до 3% по Баллингу, — 1 л. агар — 20—25 г, стерильный мел — 30 г. Стерилизуют при 0,5 атм. 30 мин.
Среда 1а. Капустный агар с мелом. Капустным бульон — 900 мл, дрожжевой экстракт - 100 мл, пептон — 10 г, глюкозa — 20 г, ацетат натрия — 3,35 г, MnSO4 - 0,025 г. aгaр — 15— 20 г. Стерильный мел добавляют в колбы из pacчета 5 г на 200 мл среды. Стерилизуют при 0.5 aтм. 30 мин.
Среда 2. Капустный агар со спиртом и мелом. В расплавленную и охлажденную до 50 °С среду прибавляют 20 мл этилового спирта (96%-ного) на 200 мл среды, тщательно взбалтывают и заливают в чашки Петри с посевным материалом.
Среда 3. Пептонный агар. Пептон — 5 г, К2 НРО4, — 1 г, КН2РО4 — 0,5 г. MgSO4 — 0,5 г, NaCI следы, водопроводная вода — 1 л, агар, хорошо промытый 15 - 20 г. Стерилизуют при 1 атм. 20 мин.
Среда 4. Сусло-агар со стрептомицином. Сусло, разбавленное до 3%, по Баллингу, - 1л. Агар – 26 г. Стерилизуют при 0,5 атм. 30 мин. Перед разливкой среды в чашки Петри в сусло-агар добавляют 80- 100 ел. стрептомицина на 1 мл среды.
Среда 4а. Подкисленный сусло-агар. Сусло, разбавленное до 3%, по Баллингу, - 1л. Агар— 20 -25 г. Стерилизуют при 0,5 атм. 30 мин. Перед разливом среды в чашки Петри в расплавленный сусло-агар добавляют прокипяченную в течение 10 мин на водяной бане молочную кислоту (2 мл на 1 л среды).
Среда 5. Картофельная среда с мелом. В пробирки вносят стерильный мел (на кончике скальпеля). 8—10 картофельных кубиков величиной 2—3 мм заливают водопроводном водой до 3/4 объема пробирок. Стерилизуют при 1 атм. 40 мин.
Среда 5а. Картофельный крахмал — 20 г, пептон— 5 г, дрожжевой автолизат — 0,2 мг, КН2РО4 — 0,5 г, К2НРО4 — 0,5 г, MgSO4 - 0,5 г, NaCI - 0,5 г, FeSO4 - 0,01 г, MnSO4 -0,01 г, СаСО3 — 10 г, смесь микроэлементов по Федорову — 1 мл, дистиллированная вода — 1 л, тиогликолевая кислота — 0,05%, нейтральрот — 0,004%, рН 7,4—7,5. Стерилизуют среду при 0,5 атм. 30 мин. Температура инкубации посевов — 30— 35°С.
Среда 6. МПБ: пептон — 10 г, NaCI — 4 г, мясной бульон — 1 л. Наливают в пробирки с поплавками до 3/4 объема. Стерилизуют при 1 атм. 20 мин.
Среда 7. Среда Гильтая (видоизмененная). Лимоннокислый натрий - 2 г, KNO3 - 1 г, КН2РО4 - 1 г, К2НРО4 - 1 г, MgSO4 — 1 г, СаС1, — 0,2 г, FeCl3 — следы, дистиллированная вода— 1л, 1%-ный раствор бромтимолблау до рН 6,8—7,0. Стерилизуют при 1 атм. 20 мин.
Среда 8. МПА и сусло-агар (1: 1). Стерилизуют при 0,5 атм. 30 мин.
Среда 9. Среда Кесслера. К 1 л водопроводной воды прибавляют 50 мл свежей бычьей желчи в 10 г пептона. Смесь кипятят 15 мин на водяной бане, взбалтывают. Когда пептон растворится, фильтруют через вату, затем прибавляют 10 г лактозы. После растворения лактозы устанавливают слабощелочную реакцию (рН 7,6) и добавляют 4 мл 1%-ного водного раствора генциана фиолетового. Полученную среду разливают в пробирки с поплавками и стерилизуют при 1 атм. 15 мин.
Среда 10. Среда Булира. К 1 л МПБ добавляют 12,5 г маннита и 6 мл 1%-ного раствора нейтральрота. Среду разливают в пробирки с поплавками и стерилизуют при 0,5 атм. 30 мин. Среда имеет вишневый цвет. При развитии кишечной палочки она становится оранжевой и в поплавке скапливается газ.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1796; Нарушение авторских прав?; Мы поможем в написании вашей работы!
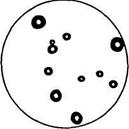 Рисунок 33- Зоны растворении мела вокруг колоний молочнокислых бактерий силоса
Рисунок 33- Зоны растворении мела вокруг колоний молочнокислых бактерий силоса