
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фонд оценочных средств (примеры решения задач по химии окружающей среды, задачи, тесты и вопросы)
|
|
|
|
С целью овладения методикой решения задач по химии окружающей среды рекомендуется проработать примеры решения задач. После выполнения заданий проводится собеседование по соответствующему разделу для выяснения и ликвидации трудностей, возникших в процессе работы.
Тема 1. Физико-химические процессы в литосфере
Глинистые и песчаные почвы имеют удельную поверхность 70 и 7 м2/г абс. сухой почвы соответственно. При условии, что воздушно-сухая почва адсорбирует воду только поверхностью однородного слоя толщиной 1 нм, вычислите содержание воды в каждой почве.
Решение:
Рассмотрим почву с удельной поверхностью Sуд= 70 м2/г. Согласно условию задачи вода в 1г почвы равномерно адсорбирована на поверхности 70м2 с толщиной слоя h= 1нм = 10 м-9 м. Определим объем, который занимает вода в 1г почвы этого образца:
V= Sудh;
V= 70 ∙ 1 ∙ 10-9 = 7 ∙10-8 м2/г.
Масса воды mв 1г образца определяется следующей формулой:
m = ρV,
где ρ− плотность воды.
Табличное значение плотности воды при стандартных условиях составляет 103 кг/м3 = 106 г/м3. Таким образом, масса воды в 1г воздушно-сухой почвы составит:
m= 106 ∙ 7∙ 10-8 = 7 ∙10-2г H2O/г почвы.
Процентное содержание воды в почве есть отношение массы воды в почве mк массе навески mн(mн= 1г):
ω (H2O) = (m/mн)∙ 100% = (7∙10-2 /1)100% = 7%.
Таким образом, масса и процентное содержание воды в образце почвы с удельной поверхностью 70 м2/г составляет соответственно 7 ∙10-2 г H2O/г почвы и 7%.
Аналогичным образом рассчитываются масса и процентное содержание воды в почве с удельной поверхностью 7м2/г. В результате соответствующих вычислений получим: 7 ∙10-3г и 0,7% соответственно.
Ответ: масса воды равна 70 и 7 мг/г абс. сухой почвы (глинистой и песчаной соответственно), или 7 и 0,7%.
Карбонатная почва имеет следующий гранулометрический состав: 24% песка и28% пыли и 20% глины. Содержание CaCO3 в почве составляет: 5% в песке, 10% в пыли и 20% в глине. Рассчитайте гранулометрический состав почвы (%): а) в ее начальном состоянии; б) после удаления карбоната кальция с кислотой.
Решение:
Определим массу карбоната кальция в каждой гранулометрической части почвы. Согласно условию задачи в 100г почвы содержится 42г песка, 38г пыли и 20г глины. Соответственно карбоната кальция содержится:
в песке 42 ∙ 0,05 = 2,1г,
в пыли 38 ∙ 0,10 = 3,8г,
в глине 20 ∙ 0,2 = 4,0г.
Таким образом масса чистых компонентов после обработки кислотой (mi) составит:
42 – 2,1 = 39,9г песка,
38 – 3,8 = 34,2г пыли;
20 – 4,0 = 16,0г глины.
Процентное содержание компонентов в исходной почве (ωi) определяется соотношением:
ωi= (mi/100)∙ 100%.
Отсюда процентное содержание компонентов в исходной почве после округления составит:
ωпеска = 40%; ωпыли = 34%; ωглины = 16%.
Процентное содержание компонентов в почве после удаления из нее карбонатов (ω*i) определяем с учетом изменения массы навески почвы:
Δm =  i = 2,1 + 3,8 + 4,0 + 9,9г.
i = 2,1 + 3,8 + 4,0 + 9,9г.
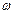 *i = [mi/(100 − Δm)]∙ 100% = [mi/(100 − 9,9)]∙ 100% = (mi/90,1)∙ 100%;
*i = [mi/(100 − Δm)]∙ 100% = [mi/(100 − 9,9)]∙ 100% = (mi/90,1)∙ 100%;
ω* песка = 44%; ω*пыли = 38%; ω*глины = 18%.
Ответ: а) 40%. 34% и 16%; б) 44%. 38% и 18%.
Из пробы почвы взята навеска массой 10г и обработана 25 мл 2М раствора HCl. По завершении реакции избыток кислоты оттитрован стандартным раствором NaOH. Расчеты показывают, что на реакцию с почвой расходуется 22,5 мл кислоты. При условии, что кислота реагирует только с CaCO3, вычислите процентное содержание этого вещества (по массе) в почве. Если кислота реагирует с доломитом CaMg(CO3)2, найдите процентное содержание этого вещества в почве.
Решение:
Соляная кислота взаимодействует с карбонатом кальция по уравнению:
CaCO3 + 2HCl  CaCl2 + CO2 + H2O.
CaCl2 + CO2 + H2O.
Определим количество кислоты, которое провзаимодействовало с CaCO3:
ν(HCl) = C(HCl) ∙ V(HCl),
где C(HCl) − концентрация соляной кислоты; V(HCl) − объем раствора кислоты, который пошел на взаимодействие с почвой (V= 22,5 мл = 22,5 ∙10-3л).
Количество карбоната кальция, вступившего в реакцию:
ν (CaCO3) = 1/2ν (HCl) = 1/2 ∙ 2 ∙ 22,5 ∙10-3 = 2,25 ∙ 10-2 моль
карбоната кальция в образце почвы составит:
m (CaCO3) = M(CaCO3) ν(CaCO3) = 100∙ 2,25 ∙ 10-2 = 2,25 г.
Процентное содержание CaCO3в навеске почвы массой 10г составит:
ω (CaCO3) = (2,25/10) 100% = 22,5%.
Аналогично определяется содержание доломита, при этом примем, что соляная кислота взаимодействует как с карбонатом кальция, так и с карбонатом магния по следующим химическим уравнениям:
CaCO3 + 2HCl  CaCl2 + CO2 + H2O;
CaCl2 + CO2 + H2O;
MgCO3 + 2HCl  MgCl2 + CO2 + H2O.
MgCl2 + CO2 + H2O.
Учитывая. что в доломите карбонаты кальция и магния находятся в эквимолярном соотношении, т.е. ν(CaCO3) = ν(MgCO3), получим. что количества CaCO3 и MgCO3равны и составляют 1,12 ∙10-2 молей.
Пересчитаем моли в граммы, используя ранее приведенное выражение:
m(CaCO3) = 100 ∙ 1,12 ∙10-2 = 1,12г;
m(MgCO3) = 84 ∙ 1,12 ∙ 10-2 = 0,94г (здесь 84 г/моль − молярная масса карбоната магния).
Масса доломита будет определяться суммой масс его составляющих − карбонатов кальция и магния, и процентное содержание доломита в этом случае составит:
ω [CaMg(CO3)2] =[(1,12 + 0,94)/10]100% = 21%
Ответ: содержание в почве CaCO3− 22,5%; CaMg(CO3)2 − 21%
Почва содержит 3,15 органического вещества. Вычислите процентное содержание углерода и азота в почве, если органическое вещество содержит 60% углерода и массовое отношение C:Nравно 10:1.
Решение:
В соответствии с условием задачи в 100г почвы содержится 3,1г органического вещества. Содержание углерода:
m(C) = (3,1/100) 60 = 1,86г.
По условию задачи содержание азота в почве составляет одну десятую от содержания углерода. т.е. m(N) = 0,186г.
Процентное содержание элементов равно:
ω (C) = [m(C)/100]100% = 1,9%;
ω(N) = [m(N)/100]100% = 0,19%.
Ответ: процентное содержание углерода и азота в почве равно 1,9% и 0,19% соответственно.
1 м2пахотного слоя почвы содержится 6,5 кг органического углерода, а интенсивность дыхания почвы составляет 9г CO2/(м2∙сут). Какая часть органического углерода теряется в сутки на дыхание? Средняя скорость выделения CO2в течение года − 2,5 г CO2/(м2∙сут), а содержание органического углерода поддерживается за счет поступления растительных остатков. Рассчитайте время оборота для углерода.
Решение:
В первую очередь определим массу углерода (mС), выделяющегося в виде CO2при дыхании почвы. При этом необходимо учесть массу углерода, которая содержится водной молекуле диоксида углерода, Составим пропорцию:
в 44г CO2содержится 12г углерода
в 9г CO2/(м2 ∙ сут) содержится mС углерода/(м2 ∙ сут).
Отсюда
mС= 9 M(C)/ М(CO2) = 9 ∙12/ 44 = 2,45 г углерода/(м2 ∙сут),
где M(C) и M(CO2) − молярные массы углерода и диоксида углерода.
Определим часть углерода (PC, %), которая теряется в сутки с дыханием, при этом содержание органического углерода в почве (Сорг) необходимо перевести в граммы:
PC= (mС/ Сорг) 100% = [2,45/(6,5∙103)] ∙100% = 0,038%.
Для ответа на второй вопрос определим отношение общего содержания углерода в почве к средней массе, выделяющейся при дыхании в течение года (365 дней):
tоборота = 6500/(2,5 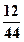 365) = 26 лет.
365) = 26 лет.
Ответ: на дыхание теряется в сутки 0,038% углерода; время оборота углерода составляет 26лет.
Представьте, что чистый гумус имеет 60 смоль карбоксильных групп на 1 кг, причем все они имеют pKД= 4,0. Рассчитайте долю групп, которые продиссоциируют при pH=3; 4; 5; и 6. Для продиссоциировавших фракций рассчитайте заряд, связанный с гумусом, при каждом значении pH.
Решение:
Карбоновые кислоты, содержащие карбоксильные группы, диссоциируют по следующему уравнению:
RCOOH  RCOO- + H+.
RCOO- + H+.
В соответствии с этим уравнением константа диссоциации (КД) определяется следующим соотношением:
КД =  ,
,
где [RCOO-], [H+] и [RCOOH] − равновесные концентрации.
Примем что х − равновесная концентрация продиссоциировавших карбоксильных групп (х = [RCOO-]). Тогда, в соответствии с химическим уравнением выражение для КД можно записать следующим образом:
КД =  ,
,
откуда
х = 
 ,
,
где С0RCOOH− исходная концентрация карбоксильных групп.
Как видно из полученной формулы, концентрация продиссоциировавших карбоксильных групп зависит от концентрации присутствующих в системе ионов водорода (pH).
при pH=3, т.е. [H+] = 10-3 моль/л, концентрация [RCOO-] составит:
[RCOO-] = 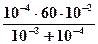 = 5,5 ∙10-2 моль/кг.
= 5,5 ∙10-2 моль/кг.
Аналогичным образом рассчитываются концентрации [RCOO-] при других значениях pH. доля продиссоциировавших карбоксильных групп (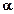 3) при pH=3 есть отношение концентрации карбоксильных групп [RCOO-] к начальной концентрации карбоксильных групп С0RCOOH:
3) при pH=3 есть отношение концентрации карбоксильных групп [RCOO-] к начальной концентрации карбоксильных групп С0RCOOH:
α3 = 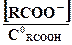 ;
;
α3 = 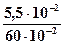 = 0,09.
= 0,09.
Аналогичным образом определяются доли продиссоциировавших карбоксильных групп при pH=4; 5 и 6. Они
Процент скомпенсированного заряда (r) составит: равны  4 = 0,50;
4 = 0,50;  5 = 0,90;
5 = 0,90; 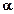 6 = 0,99 соответственно.
6 = 0,99 соответственно.
Поскольку заряд, связанный с гумусом, определяется карбоксил- анионом, а общая величина заряда определяется его концентрацией, то искомый заряд, связанный с карбоксильными группами, при pH=3 равен 5,5 смользар/кг. При pH= 4 заряд составит 30 смользар/кг, при pH=5 − 54 смользар/кг и при pH=6 − 59 смользар/кг.
Ответ: при pH=3;4;5 и6 доля продиссоциировавших карбоксильных групп составит: 0,09; 0,50; 0,91 и 0,99 соответственно; заряд, связанный с гумусом, составит 5,5; 30; 54 и 59 смользар/кг соответственно.
Доза меди, рекомендуемая для внесения в конкретную почву, составляет 115 мг/кг почвы. (Медь входит в состав хлорофилла и играет важную роль в процессах метаболизма и фотосинтеза. Дефицит меди приводит к снижению урожая.) Если почва содержит 2,5% гумуса с отрицательным зарядом 65 смользар/кг гумуса и вся медь прочно связывается гумусом при образовании хелатных комплексов, какой процент заряда гумуса компенсируется?
Решение:
В соответствии с условием задачи в почве протекает следующая реакция:
Cu2+ + 2А-  Cu2A.
Cu2A.
Таким образом, решение задачи сводится к определению избытка одного из реагентов. Количество вносимой меди равно:
ν (Сu) = m(Cu)/ M(Cu),
где m(Cu) − масса меди, вносимая в почву; M(Cu) = 63,5 г/моль − молярная масса атомов меди;
ν (Сu) = 115 · 10-3/63,5 = 1,8 · 10-3 моль/кг почвы.
Поскольку заряд катиона меди равен +2, то суммарный заряд, вносимый медью (qзар), будет равен удвоенному количеству атомарной меди и составит 1,8 ∙ 10-3∙ 2 = 3,6∙10-3
мользар/кг. Заряд. связанны с гумусом (qпочв), составит:
qпочв= mгум qгум,
где mгум − масса гумуса; qгум− заряд, связанный с гумусом в 1кг почвы;
qпочв= 0,025 ∙1 ∙ 65 ∙10-2 = 16,25 ∙ 10-3 мользар/кг.
r = [3,6∙ 10-3 / (16,25∙10-3)] ∙100% = 22%.
Ответ: компенсируется 22% заряда гумуса.
Емкость катионного обмена (ЕКО) почвы составляет 25 смользар/кг; 65% ЕКО обусловлены ионами H+и Al3+. Рассчитайте количество извести (г CaCO3/кг почвы), необходимое для нейтрализации этой обменной кислотности
Решение:
Согласно условию задачи количество зарядов, обусловленное ионами H+и Al3+, составляет:
q = ЕКО ∙α,
гдеα − доля заряда, обусловленная ионами H+и Al3+;
q = 25 ∙ 10-2∙ 0,65 = 16,25 ∙ 10-2мользаркг.
Необходимое количество CaCO3для нейтрализации с учетом того факта, что ионы кальция несут заряд +2, определяется из следующего равенства:
0,5q = ν(CaCO3) = m(CaCO3)/ M(CaCO3),
где M(CaCO3) − молярная масса карбоната кальция, равная 100г/моль.
Отсюда
m(CaCO3) = 0,5q M(CaCO3);
m(CaCO3) = 0,5 ∙ 16,25 ∙ 10-2 ∙ 100 = 8,1 г/кгпочвы.
Ответ: для нейтрализации обменной кислотности необходимо 8,1 г CaCO3/кг почвы.
В 100г дерново-подзолистой почвы в поглощенном состоянии содержится 240мг подвижного кальция, 26мг магния, 3,6мг аммония, 1мг подвижного водорода и 2,7мг алюминия. Рассчитайте ЕКО.
Решение:
Решение задачи сводится к нахождению суммарного заряда (ЕКО), определяемого перечисленными ионами, выраженного в молях:
ЕКО = 
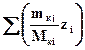 ,
,
где mкi− масса ионов i-того сорта в навеске почвы; Mкi− молярная масса ионов i-того сорта; zi− заряд ионов i-того сорта; mн− масса навески.
ЕКО = 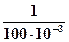
 =
=
= 15∙10-2мользар/кг почвы = 15 смользар/кг почвы.
Ответ: ЕКО = 15 смользар/кг почвы.
Потребность в извести почвы с pH=5,2, предназначенной для производства сельскохозяйственных культур, равна 8т CaCO3/га. Рассчитайте, сколько времени должно было бы пройти после внесения этого количества извести до следующего внесения, если предположить, что фермер позволил pHснизиться до 6,0. Примите, что после внесения в почву карбоната кальция значение pHдолжно достичь 6,7. Известно, что ежегодное поступление ионов водорода в почву составляет: в результате дыхания − 4,4, нитрификации − 2,0, поглощения питательных веществ − 0,7 и атмосферных поступлений − 1,3 кгН+/(га ∙ год).
Решение:
В основе решения задачи лежит представление о существовании диапазона концентраций ионов водорода (pH), оптимальных для развития сельскохозяйственных растений. Примем для решаемой задачи оптимальную величину pH, равную 6,7. Тогда
Потребность CaCO3= БЕ ∙ 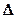 pH,
pH,
где БЕ − буферная емкость почвы, 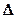 pH− изменение pH.
pH− изменение pH.
БЕ = 8/(6,7 – 5,2) = 5,3 т CaCO3/(pH∙ га).
В соответствии с условием задачи определим количество CaCO3, необходимое для доведения pHпочвы до 6,0:
Потребность CaCO3(pH=6) = 5,3(6,0 -5,2) = 4,2 т CaCO3/ га.
Таким образом, оставшаяся часть CaCO3(mост= 8,0 − 4,2 = 3,8т) идет на взаимодействие с поступающими из различных источников ионами водорода по уравнению:
CaCO3 + 2H+  Ca2+ + H2O + CO2.
Ca2+ + H2O + CO2.
Количество CaCO3 составит
ν (CaCO3) = mост/M(CaCO3) = 3800/100 = 38 кмоль,
где M(CaCO3) − молярная масса карбоната кальция, равная 100 кг/кмоль.
Сумма всех поступлений ионов водорода в почву ν(H+) равна:
ν (H+) =(4,4 +2,0 + 0,7 + 1,3)/ 1 = 8,4 кмоль H+/(га ∙ год).
Поскольку реагенты вступают в реакцию в стехиометрическом соотношении,
ν(CaCO3) = 0,5 ν(H+)τ,
где  τ − время до следующего внесения CaCO3 в почву;
τ − время до следующего внесения CaCO3 в почву;
t = 2ν(CaCO3) /ν(H+) = 2 ∙38/8,4 = 9 лет.
Ответ: до следующего внесения извести в почву должно пройти 9 лет.
Тема 1. Физико-химические процессы в атмосфере
Определите максимальную длину волны излучения, способного вызвать диссоциацию молекул кислорода. Принять, что вся энергия фотона расходуется на процесс диссоциации, а энергия связи одного моля кислорода, равная 498,3 кДж/моль, эквивалентна энергии диссоциации.
Решение:
Поглощение фотонного излучения может вызвать фотодиссоциацию молекул кислорода:
O2 + hν→ O + O.
По условию задачи энергия диссоциации молекулы О2 равна энергии связи и равна энергии фотона:
Едис == Есв + Еф,
где Есв − энергия связи в одной молекуле кислорода; Есв можно найти, разделив значение энергии связи для одного моля вещества на число молекул в одном моле, т.е. на число Авогадро:
Есв = 498,3(кДж/моль)/ (6,02 · 1023)(моль-1) = 8,28 · 10-22 кДж = 8,28 · 10-19 Дж.
Энергия фотона связана с длиной волны излучения уравнением Эйнштейна:
Е = hc /λ,
где h − постоянная Планка; с − скорость света в вакууме; λ − длина волны излучения.
Отсюда можно определить максимальную длину волны излучения, способного вызвать диссоциацию молекул кислорода:
λ = hc/ Еф = hc/ Еф;
λ = 6,626 · 10-34 (Дж · с) · 2,997 · 108 (м/с)/[ 8,28 · 10-19 (Дж)] = 2,40 ·10-7 м = 240 нм.
Ответ: максимальная длина волны излучения, способного вызвать диссоциацию молекулы кислорода, составляет 240 нм.
Известно, что окисление оксида азота (NO) может протекать при взаимодействии с молекулярным кислородом и озоном. Рассчитайте время полувыведения оксида азота из приземного слоя атмосферы и определите, какой из этих процессов вносит основной вклад в окисление NO. Принять, что содержание молекул оксида азота в воздухе в среднем составляет 2 · 109 см-3, а концентрация озона равна 15 млрд-1. Константы скоростей реакций окисления оксида азота кислородом воздуха и озоном равны соответственно: kк = 1,93 · 10-38 см6 · мол-1 · с-1 и kо = 1,8 · 10-14 см3 · мол-1 · с-1. Температура воздуха 15°С, давление 101,3 кПа.
Решение:
Определим время полувыведения оксида азота из воздуха при его взаимодействии с молекулярным кислородом. Процесс окисления в рассматриваемом случае описывается уравнением:
2 NO + O2 = 2 NO2.
Скорость процесса окисления NO равна:
υ(NO) = kк [NO]2 [O2],
где υ(NO) − скорость процесса окисления NO, см-3 · с-1; kк − константа скорости реакции третьего порядка, см6 · мол-1 · с-1; [NO], [O2] − концентрации оксида азота и кислорода в воздухе, см-3.
Часто для упрощения записи размерностей констант скоростей второго порядка и третьего порядка слово молекула опускается и тогда эти размерности можно записать как см3 · с-1 и см6 · с-1.
Концентрация молекул кислорода в приземном слое воздуха равна 20,95%(об.), что составляет (см. пример 2.4):
[O2] = 2,55·1019· 0,2095 = 5,34·1018 см-3.
Поскольку концентрация молекул кислорода в воздухе значительно превосходит концентрацию молекул оксида азота, можно считать, что концентрация кислорода в ходе реакции практически не изменяется. Поэтому скорость реакции окисления оксида азота можно представить как скорость реакции псевдовторого порядка уравнением:
υ(NO) = kк* [NO]2,
где kк* − константа скорости реакции псевдовторого порядка, см3 · с-1;
kк* = kк [O2] = 1,93 · 10-38 · 5,34 · 1018 = 10,31 · 10-20 см3 · с-1.
Для реакции второго порядка время (период) полувыведения, т.е. время, за которое концентрация исходных реагентов снизится вдвое. При условии равенства исходных концентраций реагентов определяется по уравнению:
τ1/2 = 1/(kС),
где k − константа скорости реакции второго порядка, см3 · с-1; С0 − начальная концентрация исходного реагента, см-3.
В рассматриваемом случае для реакции псевдовторого порядка имеем:
τ1/2 = 1/(kк*[NO])
τ1/2 = 1/(10,31 · 10-20 · 2 ·109) = 4,8 ·109 с = 150 лет.
Определим время полувыведения оксида азота из приземного слоя воздуха при его взаимодействии с озоном. В этом случае уравнение реакции окисления NO имеет следующий вид:
NO + O3 → N2 + O2.
Скорость реакции можно рассчитать по уравнению:
υ*(NO) = kо[NO] [O3],
где υ*(NO) − скорость процесса окисления оксида азота озоном, см-3 · с-1; kо − константа скорости реакции окисления оксида азота озоном, см3 · с-1; [NO] и [O3] − концентрации оксида азота и озона в воздухе, см-3
По условию задачи концентрация молекул озона в приземном воздухе равна 15 млрд-1; в 1см3 это составит (см пример 2.1):
[O3] = 2,55 · 1019 · 15 · 10-9 = 3,82 · 1011 см-3;
где 10-9 − коэффициент перевода млрд-1 в объемные (мольные) доли.
Поскольку концентрация озона более чем в сто раз превышает концентрацию оксида азота, можно принять, что в процессе окисления NO значение концентрации озона практически не изменится. В этом случае скорость реакции можно представит как скорость реакции псевдопервого порядка:
υ*(NO) = kо*[NO],
где kо* − константа скорости реакции псевдопервого порядка;
kо* = kо [O3], = 1,8 ·10-14 · 3,82 · 1011 = 6,88 · 10-3 с-1.
Для реакции первого порядка время полувыведения реагента определяется по уравнению:
τ1/2 = 0,693 / k,
где k − константа скорости реакции первого порядка.
В рассматриваемом случае для реакции псевдопервого порядка имеем:
τ1/2 = 0,693 / kо* = 0,693 / (6,8810) = 100с = 1,7 мин.
Время полувыведения оксида азота в процессе его окисления кислородом воздуха значительно больше, чем при взаимодействии NO c озоном, и не соответствует реально наблюдаемым в приземном слое процессам превращения оксида и диоксида азота. В атмосферном воздухе время полувыведения оксида азота обычно составляет несколько минут. Поэтому можно утверждать, что в приземном слое воздуха процесс окисления оксида азота связан в основном со взаимодействием с озоном.
Ответ: время полувыведения оксида азота при его взаимодействии с кислородом и озоном составляет 150 лет и 1,7 мин. соответственно. В приземном слое процесс окисления NO в основном протекает при участии озона.
Сравните скорости выведения из атмосферы молекул метана при их взаимодействии с гидроксильным радикалом на высотах 5 и 35 км. Концентрация метана изменяется от 2 млн-1 на высоте 5 км до 0,6 млн-1 на высоте 35 км. Энергия активации и предэкспоненциальный множитель константы скорости реакции взаимодействия метана с ОН-радикалом равны 14,1 кДж/моль и 2,3 см3 ∙ с-1 соответственно. Концентрация гидроксильных радикалов соответствует средним для этих высот значениям: [ОН] = 8,5 ∙ 105 см-3 и [ОН] = 3 ∙ 107 см-3.
Решение:
В процессе взаимодействия молекул метана с гидроксильным радикалом происходит образование воды и метильного радикала:
CH4 + OH → CH3 + H2O.
Скорость реакции можно определить по уравнению:
υН = kН[CH4]Н[OH]Н,
где υН и kН − скорость и константа скорости реакции для условий, характерных для атмосферного воздуха на высоте Н; [CH4]Н и [OH]Н − концентрации молекул метана и гидроксильного радикала на высоте Н.
В соответствии с уравнением Аррениуса константа скорости химической реакции зависит от температуры:
k = А exp(-E/RT),
где k − константа скорости химической реакции (размерность определяется единицами измерения концентрации и времени, а также порядком химической реакции); А − предэкспоненциальный множитель (имеет размерность константы скорости реакции); Е − энергия активации реакции, Дж/моль; Т − температура реакции, К.
В рассматриваемом случае скорость химической будет определяться значениями концентраций реагентов и температурой воздуха на заданных высотах.
Температура воздуха на высоте 5 км составляет Т = 288 + (-6,45) · 5 = 256 К,
на высоте 35 км она равна:
Т = 288 + (-6,45) · 11 + 1,38 · (35 -11) = 250 К.
Константа скорости реакции на высоте 5 км составляет:
k5 = 2,3 exp [-14,1 · 103/(8,314 · 256)] = 3,04 · 10-3 cм3 · с-1,
а на высоте 35 км
k35 = 2,3 exp [-14,1 · 103/(8,314 · 250)] = 2,59 · 10-3 cм3 · с-1.
Для расчета скорости химической реакции необходимо привести значения концентраций реагентов и константы скорости реакции к одинаковым единицам измерения.
Переведем заданные в условии задачи значения концентраций молекул метана в см-3:
[CH4]Н = Nвозд Н · φ(CH4)Н · 10-6,
где Nвозд Н − концентрация молекул в 1 см3 воздуха на заданной высоте; φ(CH4)Н · 10-6 − мольная доля метана в воздухе на заданной высоте.
Концентрацию молекул в 1см3 воздуха на некоторой высоте можно определить по уравнению (пример 2.4):
Nвозд Н = Nвозд З exp[− Мвозд gH/(RTH)],
Следовательно на высоте 5 км концентрация молекул в воздухе будет равна
Nвозд 5 = 2,55 · 1019 exp[−28,96 · 10-3 · 9,8 · 5000/(8,314 · 256)] = 1,31 · 1019см-3,
а на высоте 35 км
Nвозд 35 = 2,55 · 1019 exp[−28,96 · 10-3 · 9,8 · 35000/(8,314 · 250)] = 2,12 · 1017см-3.
Концентрация молекул метана в 1см3 воздуха на высоте 5 км составит:
[CH4]5 = 1,31 · 1019 · 2 · 10-6 = 2,62 · 1013 см-3,
а на высоте 35 км
[CH4]35 = 2,12 · 1017 · 0,6 · 10-6 = 1,27 · 1011 см-3.
Скорость химической реакции на высоте 5 км составит:
υ5 = 3,04 · 10-3 · 2,62 · 1013 · 8,5 · 105 = 6,77 · 1016см-3 · с-1,
а на высоте 35 км
υ35 = 2,59 ·10-3 · 1,27 · 1011 · 3 · 107 = 9,86 · 1015см- 3 · с-1.
Отношение скоростей химических реакций взаимодействия метана с гидроксильным радикалом составит:
υ5/ υ35 = 6,77 · 1016 /(9,86 · 1015) = 6,87 ≈ 7.
Ответ: скорость процесса выведения метана из атмосферы при его взаимодействии с гидроксильным радикалом на высоте 5 км в 7 раз выше, чем на высоте 35 км.
Определите соотношение скоростей процессов газофазного и жидкофазного окисления диоксида серы при условии, что основной вклад в эти процессы вносят следующие реакции:
SO2 (г) + OH (г) → HSO3 (г)
SO2 (г) + H2O2 (р-р) → H2SO4 (р-р).
Константы скоростей реакций окисления равны: k1 = 9 ∙ 10-13 см3 ∙ мол-1∙ с-1; k2 = 1∙10 л ∙ моль-1∙ с-1. Концентрации примесей в газовой фазе составляют:[OH] = 5 ∙ 106см-3; [SO2 ] = 10-4%(об.); [H2O2] = 10-7%(об.). Расчеты провести для атмосферного воздуха, имеющего температуру 25 С и содержащего: а) 0; б) 0,0001; в) 0,01 г свободной воды в каждом литре воздуха. Считать, что при растворении в воде концентрация диоксида серы в газовой фазе не меняется. Газы считать идеальными и подчиняющимися закону Генри. Давление принять равным 1 атм.
Решение:
Скоростьокисления в газовой фазе можно определить по уравнению:
υ1 = k1 [OH] [SO2],
где k1 − константа скорости реакции; [OH] и [SO2], − концентрации реагентов в газовой фазе.
Для определения скорости реакции переведем размерность концентрации
SO2 из объемных (мольных) долей в см-3:
[SO2](см-3) = (NА/VМ) ∙ φ(SO2) = [NАT0/(VМ0T1)] ∙ φ(SO2) =
= [6,02 ∙ 1023 ∙ 273/(22,4∙ 10 3∙ 298)] ∙ 10-4 ∙10-2 = 2,46 ∙ 1013 см-3.
Скорость газофазного окисления составит:
υ1 = 9 ∙ 10-13 ∙ 5 ∙ 106 ∙ 2, 46 ∙ 1013 = 1,1 ∙108 см-3 ∙ с-1.
В случае отсутствия свободной (капельножидкой) воды в атмосфере (вариант «а») окисление в жидкой фазе происходить не может, и скорость процесса полностью определяется скоростью газофазного окисления. В случае присутствия капельножидкой воды в воздухе окислению в жидкой фазе предшествует растворение газов в воде. Концентрацию компонентов в растворе, в соответствии с законом Генри, можно определить по уравнению:
Сі = КГі Рі,
где Сі − концентрация і-го компонента в растворе; КГі значение константы Генри для і-го компонента (приводятся в справочной литературе); Рі − парциальное давление і -го компонента в газовой фазе.
Окислению в жидкой фазе предшествует растворение в воде. Константы Генри для этих газов при 25°С составляют:
КГ (SO2) = 5,4 моль/(л ∙ атм)
КГ (H2O2) = 1 ∙ 105 моль/(л ∙ атм).
Парциальное давление легко найти, зная объемную долю соответствующего компонента в газовой фазе и общее давление воздуха:
P(SO2) = Pвозд · φ(SO2) = 1 · 10-4 10-2 = 10-6 атм
P(H2O2) = Pвозд · φ(H2O2) = 1 · 10-7 · 10-2 = 10-9 атм.
Концентрации компонентов в растворе составят:
[SO2] = 5,4 · 10-6 моль/л
[H2O2 ] = 1 · 105 · 10-9 = 10-4 моль/л.
Скорость процесса окисления SO2 в жидкой фазе можно определить по уравнению:
υ2 = k2 [SO2] [H2O2];
υ2 = 1· 103 · 5,4 · 10-6 · 10-4 = 5,4 · 10-7 [ моль/(л · с)].
Полученное значение скорости окисления SO2 в жидкой фазе показывает, что в каждом литре раствора в секунду будет окисляться 5,4 · 10-7 молей SO2.
Эту величину трудно сравнить с полученным выше значением скорости окисления SO2 в газовой фазе, которое показывает число молекул, окисляющихся в каждом кубическом сантиметре воздуха в секунду. Поэтому, зная содержание свободной воды в воздухе и принимая плотность раствора равной плотности воды, приведем значение скорости окисления SO2 в жидкой фазе к сопоставимым единицам измерения:
υ2 [мол./(см3 · с)] = υ2 [моль/(л · с)] n NA/γ,
где n − содержание капельножидкой воды в воздухе, г(воды)/см3(воздуха); NA − число Авогадро; γ − плотность воды, г/л.
Подставив соответствующие численные значения, получим зависимость скорости окисления от содержания влаги в воздухе:
υ2 [мол./(см3 · с)] = υ2 [моль/(л · с)] n 6,02 · 1023 ·10-3/1000 = 5,4 10-7 · n 6,02 · 1017 = 3,25 · 1011n, где 10-3 − переводной коэффициент из литров в см3.
В случае, когда содержание воды в воздухе n = 0,0001 г/л (вариант «б»), соотношение скоростей окисления SO2 в газовой и жидкой фазах составит:
α = υ1/υ2 = 1,1 · 108 /(3,25·1011 · 0,0001) = 3,4
В случае n = 0,01 г/л (вариант «в») это отношение будет:
α = υ1/υ2 = 1,1 · 108 /(3,25 · 1011 · 0,01) = 0,034.
Ответ: а) при отсутствии капельножидкой воды в воздухе скорость окисления диоксида серы определяется процессом окисления в газовой фазе; б) при содержании влаги в воздухе, равном 0,0001 г/л, скорость окисления SO2 в газовой фазе будет превышать скорость жидкофазного окисления в 3,4 раза; в) при содержании влаги в воздухе, равном 0,01 г/л, окисление будет протекать с большей скоростью в жидкой фазе, в этом случае соотношение скоростей окислении я SO2 в газовой и жидкой фазах будет равно 0,034.
Оцените, во сколько раз скорость связывания атомарного кислорода в реакции синтеза озона выше, чем в реакции разрушения озона, когда эти процессы протекают при нормальном атмосферном давлении у поверхности Земли. Концентрация озона в приземном воздухе составляет 4 ·1011 см-3. Константа скорости образования озона kобр = б,9 · 10-34 см6 · с-1, если третье тело − молекулы кислорода. Константа скорости процесса разрушения озона при взаимодействии с атомарным кислородом kгиб = 8,4 · 10-15 см3 · с-1.
Решение:
Процессы образования и гибели озона в реакциях связывания атомарного кислорода можно представить уравнениями:
O(3P) + O2 + M → O3 + M* (1)
O(3P) + O3 → 2 O2, (2)
где O(3P) − атомы кислорода в невозбужденном состоянии; М − третье тело, участвующее в реакции образования озона.
Скорости образования и гибели озона по реакциям (1) и (2) можно выразить уравнениями:
υобр = kобр[O(3P)][O2][М],
υгиб = kгиб [O(3P)][O3]
Отношение скоростей реакций образования и гибели озона можно определить как:
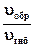 =
= 
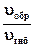 =
= 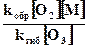 .
.
В случае, когда третье тело в процессе образования озона − молекулы кислорода ([O2] = [М]), отношение скоростей реакций (1) и (2) составит:
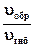 =
=  .
.
Таким образом для решения задачи необходимо найти содержание молекул кислорода в кубическом сантиметре воздуха.
Среднее значение температуры приземного воздуха соответствует средней температуре нижней границы тропосферы и равно 15°С. При нормальном атмосферном давлении концентрация молекул кислорода составит (см. пример 2.):
[O2](см-3) = (NА/VМ) ∙ φ(O2) = [NАT0/(VМ0T1)] ∙ φ(O2) =
= 6,02 ·1023 · 273/(22,4 · 103 · 288) = 5,34 ·1018 см-3.
Отношение скоростей реакций (1) и (2) составит:
 .
.
Ответ: скорость связывания атомарного кислорода в реакции образования озона в 5,9 · 106 раз больше, чем в реакции гибели озона.
Определите концентрацию атомарного кислорода в состоянии О(3Р) на высоте 20 км при условии динамического равновесия между процессами его образования (при фотолизе зона и диоксида азота) и стока (при образовании озона). Концентрации озона и диоксида азота составляют:[О3] = 1,5 · 1012, [NO2] = 3 · 104 см. Коэффициенты фотодиссоциации озона и диоксида азота на высоте 20 км равны: J(O3) = 2,1 · 10-4 с-1; J(NO2) = 4,4 ·10-3 с-1. Константа скорости реакции образования озона в случае, когда третьим телом являются молекулы азота, определяется по уравнению:
k = 6,2 · 10-34 (300/T)2 см6 · с-1,
где Т − температура реакции.
Решение:
Представим процесс образования атомарного кислорода в виде уравнений реакций:
O3 + hν → O2 + O(3P)
NO2 + hν → NO + O(3P).
Скорости процессов фотохимического разложения озона и диоксида азота можно выразить соотношениями:
υ1 = J(O3) [O3]
υ2 = J(NO2) [NO2].
Скорость образования атомарного кислорода в О(3Р) состоянии будет численно равна сумме скоростей процессов фотолиза О3 и NО2, поскольку по условию задачи другие источники поступления О(3Р) не принимаются во внимание и в процессе фотохимического разложения по реакциям (1) и (2) на каждую молекулу озона и диоксида азота образуется один атом кислорода. Поэтому можно записать:
υобр = υ1 + υ2.
Процесс стока атомарного кислорода по условию задачи связан только с образованием молекул озона:
O(3P) + O2 + M → O3 + M*.
Скорость этой реакции можно представить уравнением:
υст = k[O(3P)][O2][М],
где k − константа скорости образования озона; [М] − концентрация третьего тела, в рассматриваемом случае − концентрация азота на высоте 20 км.
В условиях динамического равновесия скорости процессов образования и стока атомарного кислорода численно равны:
υобр = υст
υ1 + υ2 = υст
J(O3)[O3] + J(NO2)[NO2] = k[O(3P)][O2][М].
Из полученного уравнения можно выразить концентрацию атомарного кислорода:
[O(3P)] = 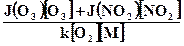
Таким образом, для решения задачи следует определить значения концентраций всех компонентов и констант и выразить их в одинаковых единицах измерения.
Определим температуру на высоте 20 км. Ее значение необходимо для расчета концентрации азота и определения константы скорости реакции образования озона на данной высоте. Эта область находится в стратосфере. И температуру можно определить по уравнению (пример 3.3):
T = 288 + ΔTтроп Hтроп + ΔTстр(Н – Hтроп) = 217 + ΔTстр(Н – Hтроп),
где Н − высота в стратосфере, для которой определяется температура; Нтроп − высота верхней границы тропосферы (нижней границы стратосферы), равная 11 км; ΔТтроп − температурный градиент в тропосфере, равный -6,45 К/км; ΔТстр − температурный градиент в стратосфере, равный +1,38 К/км.
Т = 217 + 1,38(20 – 11) = 229 К
Для определения концентрации молекул азота на высоте 20 км необходимо рассчитать концентрацию молекул воздуха на данной высоте (см. пример 2):
Nвозд Н = Nвозд З exp[−МвоздgH/(RTH)] =
= 2,55 ·1019exp[-28,96 · 10-3 · 9,8 · 20000/(8,314 · 229)] = 5,04 · 1017 см-3.
Поскольку в атмосферном воздухе соотношение основных компонентов до высоты 100 км практически не меняется. Концентрация молекул азота на высоте 20 км будет равна:
[N2]Н = Nвозд Н · φ [N2] = 5,04 ·1017 · 78,11·10-2 = 3,94 · 1017см-3.
Концентрация молекулярного кислорода на высоте 20 км составит:
[O2]H = Nвозд Н · φ [O2] = 5,04 ·1017 · 20,95 · 10-2 = 1,06 · 1017см-3.
Константа скорости образования озона на высоте 20 км равна:
k = 6,2 · 10 -34(300/T)2 = 6,2 · 10 -34(300/229)2 = 1,06 · 10-33см6 · с-1.
Концентрация атомарного кислорода составит:
[O(3P)] = 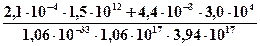 = 7,1 · 106см-3.
= 7,1 · 106см-3.
Ответ: концентрация атомарного кислорода составит 7,1 ·106см-3.
На сколько миллиграммов в каждом литре воды уменьшится равновесное содержание кислорода в верхнем слое воды природного водоема при увеличении температуры приземного воздуха с 5°С до 25°С, если его парциальное давление не изменилось, концентрация кислорода соответствует средним для приземного слоя значениям, давление воздуха соответствует стандартному значению? Парциальным давлением паров воды можно пренебречь.
Решение:
Равновесное содержание растворенного кислорода в верхнем слое природного водоема С(O2)р-р, в соответствии с законом Генри, зависит от парциального давления кислорода P(O2) и значения константы Генри KГ(O2), изменяющейся в зависимости от температуры:
С(O2)р-р = KГ(O2) · P(O2).
Поскольку по условию задачи парциальное давление кислорода не изменялось, различие равновесных значений концентраций кислорода при температурах 5 и 15 С связано лишь с изменением константы Генри. Поэтому можно записать:
ΔС(O2)р-р = С(O2)р-р1 − С(O2)р-р2 = [ KГ(O2)1 −KГ(O2)2] P(O2),
где С(O2)р-р1, С(O2)р-р2 и KГ(O2)1, KГ(O2)2 − равновесные значения концентрации кислорода в воде и значения константы Генри при 5 и 15 С соответственно.
Значения константы Генри при различных температурах приводятся в справочной литературе:
KГ(O2)1 = 0,00191 моль/(л · атм) при 5°С,
KГ(O2)2 = 0,00130 моль/(л · атм) при 15°С.
Парциальное давление кислорода можно определить, зная общее давление воздуха Pобщ и объемную долю кислорода в приземном слое φ(O2) (поскольку по условию задачи парциальным давлением паров воды в воздухе можно пренебречь, объемную долю кислорода можно принять равной объемной доле кислорода для сухого воздуха в приземном слое атмосферы):
P(O2) = Pобщ· φ(O2) = 1 · 0,2095 = 0,2095 атм.
Равновесное содержание кислорода в растворе равно:
ΔС(O2)р-р = (0,00191 - 0,00130) · 0,2095 = 1,28 · 10-4 моль/л.
Для перевода концентрации в мг/л необходимо умножить полученное значение на величину молярной массы кислорода (32 · 10-3 мг/моль).
ΔС(O2)р-р* = ΔС(O2)р-р · М(O2) = 1,28 ·10-4 ·32 ·10-3 = 4,1 мг/л.
Ответ: содержание кислорода в каждом литре воды уменьшится на 4,1 мг.
Тема 3. Физико-химические процессы в гидросфере
Какая природная вода (из двух) более агрессивна по отношению к гипсу (СaSO4 · 2 HO2), если активность катионов кальция и анионов SO42- для первой и второй воды составляет:
а1(Ca2+) = 10-3моль/л; а2(Ca2+) = 10-2,8моль/л;
a1(SO42-) = 10-1,5моль/л; a2(SO42-) = 10-2 моль/л?
Решение:
Агрессивность природных вод по отношению к одному и тому же веществу тем выше, чем больше численное значение показателя агрессивности (А), который может быть определен по уравнению:
A = lg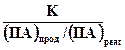 ,
,
где K − константа равновесия процесса растворении я данного вещества; (ПА)прод − произведение активностей продуктов реакции, содержащихся в данной воде; (ПА)реаг − произведение активностей реагентов, содержащихся в растворяемого веществе соответственно.
Показатель агрессивности воды часто используют для сравнения растворяющей способности природных вод. Чем больше А, тем в большей степени система неравновесна и тем более интенсивно протекает процесс растворения данного вещества.
Процесс растворения гипса протекает по уравнению:
CaSO4·2H 2O ↔ Ca2+ + SO42- + 2 H2O.
По условию задачи необходимо сравнить агрессивность двух различных по составу вод по отношению к одному и тому же соединению. Активность которого равна единице, (ПА)реаг = 1. Поэтому можно упростить выражение для показателя агрессивности:
A = lg [K/(ПА)прод]
Поскольку значение константы равновесия процесса растворения гипса при заданных условиях − величина постоянная, показатель агрессивности будет тем больше, чем меньше произведение активностей реагентов в воде. Поэтому для решения задачи необходимо сравнить произведения активностей в различных природных водах:
для первой воды
(ПА)1 = a1(Ca2+) a1(SO42-) = 10-3 10-1,5 = 10-4,5 (моль/л)2
для второй воды
(ПА)2 = а2(Ca2+) a2(SO42-) = 10-2,8 10-2 = 10-4,8 (моль/л)2.
Поскольку (ПА)2 < (ПА)1, так как 10-4,8 < 10-4,5, вторая природная вода более агрессивна по отношению к гипсу.
Ответ: вторая вода более агрессивна по отношению к гипсу.
Какой процесс − растворение или осаждение гипса − будет происходить при его контакте с природной водой, в которой активности катионов кальция и анионов SO42- составляют10-4 и 10-2 моль/л соответственно? Температура равна 298 К, давление равно 1атм.
Решение:
Процесс растворения гипса, как было сказано выше, протекает по уравнению:
CaSO4·2H 2O ↔ Ca2+ + SO42- + 2 H2O.
Направление процесса (растворение или осаждение) можно определить по значению показателя степени неравновесности:
Θ = (ПА)прод/К,
где (ПА)прод − произведение активностей ионов в растворе; К − константа равновесия процесса растворения.
Степень неравновесности характеризует ненасыщенность (Θ<1, идет процесс растворения) или пересыщенность (Θ >1, идет процесс осаждения) раствора. В случае, если степень неравновесности равна единице в системе наблюдается равновесие между твердой и жидкой фазами.
Произведение активностей продуктов процесса растворения гипса в данном случае следует принять равным произведению активностей соответствующих ионов в природной воде, поскольку для этой воды и необходимо определить степень неравновесности. Произведение активностей составит:
(ПА)прод = a(Ca2+) a(SO42-) = 10-4 · 10-2 = 10-6 (моль/л)2
Значение константы равновесия реакции растворения гипса можно определить из термодинамических данных по уравнению изотермы химической реакции для стандартных условий:
ln Ka = − ΔG0реакц/(RT).
Значение ΔG0реакц определим из выражения:
ΔG0реакц = ∑ΔG0прод −∑ΔG0реаг = ΔG0обр(Сa2+) + ΔG0обр(SO42-) + 2ΔG0обр(H2O) −
2 ΔG0обр(CaSO4 · 2 H2O) = (-552.70) + (-743,99) + 2(-237,23) − (-1799,8) =
28,65 кДж/моль = 28,65 ·103 Дж/моль.
lnKa = − 28,65 ·103/(8,314 · 298) = - 11,56
Ka = 9,55 · 10-6.
Значение показателя неравновесности составит:
Θ = 10-6 /(9,55 ·10-6) = 0,1
Поскольку Θ < 1, раствор ненасыщен относительно гипса, и идет процесс его растворения.
Ответ: будет происходить растворение гипса.
Какой из минералов, не содержащих примесей, − гипс (CaSO4·2H2O) или ангидрит (CaSO4) − более устойчив в водном растворе:
а) при нормальном атмосферном давлении и температуре 25°С
б) при нормальном атмосферном давлении и температуре 90°С?
Решение:
ΔG0реакц = ∑ΔG0прод −∑ΔG0реаг = ΔG0обр(Сa2+) + ΔG0обр(SO42-) − ΔG0обр (СaSO4) =
-552,70 + (-747,99) - (-1323,90) = 27,21 кДж/моль = 27,21·103 Дж/моль.
ln K1 = -27,21 · 103/(8,314 · 298) = -10,98,
Относительную устойчивость минералов можно определить по величине показателя устойчивости:
I = lg ,
,
Показатель устойчивости равен показателю агрессивности (см. пример 5.2), взятому с обратным знаком:
I = − A.
Показатель устойчивости удобно использовать при сравнении устойчивости различных твердых веществ по отношению к одной и той же природной воде. Чем меньше показатель устойчивости, тем менее устойчиво данное вещество.
Представим процесс растворения данных минералов в идее уравнений реакций:
CaSO4·2H 2O ↔ Ca2+ + SO42- + 2 H2O,
CaSO4 ↔ Ca2+ + SO42-.
Следует обратить внимание на то, что в обоих случаях в процессе растворения образуются одни и те же ионы. Поэтому для одной и той же воды, относительно которой будет рассматриваться устойчивость минералов, величина (ПА)прод в обоих случаях буде постоянной.
Поскольку по условию задачи минералы не содержат примесей, (ПА)реаг в обоих случаях равны единице: (ПА)реаг = 1.
Таким образом, показатель устойчивости будет тем больше, чем больше константа равновесия реакции, и для ответа на вопрос задачи необходимо сравнить значения констант равновесия процессов растворения гипса и ангидрита.
Поскольку константы равновесия процессов растворения зависят от температуры и давления, рассмотрим устойчивость минералов в различных условиях.
а) Процесс растворения протекает при Т1 = 298 К. В этом случае могут быть определены по уравнению изотермы химической реакции для стандартных условий:
ln K = − ΔG0реакц/(RT).
Для процесса растворения гипса значение константы равновесия при стандартных условиях составляет (см. пример 5.3):
К1 = 9,55 · 10-6.
Для процесса растворения ангидрита имеем:
К1 = 1,68 ·10-5.
Поскольку константа равновесия процесса растворения гипса меньше, чем ангидрита, гипс более устойчив в водном растворе при стандартных условиях и Т1=298К.
б) Процесс растворения  протекает при нормальном давлении и температуре 90°С (Т2=363К). Для определения констант равновесия процессов растворения гипса и ангидрита воспользуемся уравнением изобары химической реакции в интегральной форме:
протекает при нормальном давлении и температуре 90°С (Т2=363К). Для определения констант равновесия процессов растворения гипса и ангидрита воспользуемся уравнением изобары химической реакции в интегральной форме:
ln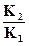 = ΔH0реакц
= ΔH0реакц 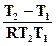 .
.
Изменение энтальпии в ходе реакции можно определить по уравнению:
ΔH0реакц = ∑ΔH0прод − ∑ΔH0реаг.
Для процесса растворения гипса имеем:
ΔH0реакц = ΔH0обр(Сa2+) + ΔH0обр(SO42-) + 2ΔH0обр(H2O) − 2 ΔH0обр(CaSO4 · 2 H2O)
= -542,7 + (-909,3) + 2(-285,8) - (-2027,7) = 4,1 кДж/моль = 4,1 · 103 Дж/моль.
Логарифм отношения констант равновесия процессов растворения гипса при температурах 363 и 298 К составит:
ln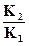 =
=  = 0,296
= 0,296
К2/К1 = 1,34.
Константа равновесия процесса растворения гипса при температуре 363 К составит:
К2 = 1,34 К1 = 1,34 · 9,55 · 10-6 = 1,28 · 10 -5.
Проведем аналогичные расчеты для процесса растворения ангидрита:
ΔH0реакц = ΔH0обр(Сa2+) + ΔH0обр(SO42-) − ΔH0обр(CaSO4) =
= -542,7 + (909,3) - (-1436,3) = -15,7 кДж/моль = -15, 7 · 103 Дж/моль;
ln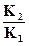 =
= 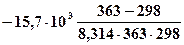 = -1,135;
= -1,135;
К2/К1 = 0,32;
К2 = 0,32 К1 = 0,32 · 1,68 ·10-5 = 5,38 ·10-6.
Таким образом, при 90°С константа равновесия процесса растворения ангидрита меньше, чем константа растворения гипса при этой температуре:
5,38 ·10-6 < 1,28 · 10 -5,
поэтому в этих условиях ангидрит более устойчив, чем гипс.
Ответ: при температуре 298К гипс более устойчив, чем ангидрит, а при температуре 363К ангидрит становится более устойчивым.
Сколько миллиграммов ионов фтора может содержаться при нормальных условиях в природной воде, не содержащей примесей и находящейся в равновесии с флюоритом (CaF2), если:
а) в исходной воде отсутствовали растворенные примеси;
б) в исходной воде содержались ионы натрия и хлора в концентрации 0,15 М?
Сравните полученные значения с ПДК ионов фтора в водоемах рыбохозяйственного назначения (ПДКр.х. = 0,75 мг/л).
Решение:
Процесс растворения фторида кальция (флюорита) в воде можно представить следующим уравнением реакции:
CaF2 ↔ Ca2+ + 2 F-.
Произведение растворимости фторида кальция
ПР(CaF2) = [Ca2+][ F-]2.
Поскольку, как следует из уравнения реакции, при растворении 1 моля фторида кальция образуется 1 моль катионов кальция и 2 моль ионов фтора, а другие источники данных ионов отсутствуют, можно записать:
[Ca2+] = [ F-]/2.
В этом случае произведение растворимости для данного процесса можно представить в виде:
ПР(CaF2) =[ F-]3/2.
Отсюда легко получить выражение для определения концентрации ионов фтора в равновесном растворе:
[ F-] = [2 ПР(CaF2)]1/3.
Произведение растворимости может быть рассчитано из определяемой по термодинамическим данным константы равновесия. Если процесс растворения чистого твердого вещества происходит в соответствии с уравнением:
АаВв = аА+в + вВ-а,
то константа равновесия в этом случае равна произведению активностей образующихся ионов в степенях, соответствующих их стехиометрическим коэффициентам:
Ка = аАа аВв = γАа γВв [А+в]а [В-а]в = γАа γВв ПР(АаВв),
где γА,γВ − коэффициенты активности А и В, [А+в], [В-а] − молярные концентрации ионов в растворе, ПР(АаВв) − произведение растворимости АаВв.
Откуда ПР(АаВв) = Ка/ γАа γВв.
Применительно к рассматриваемому случаю
ПР(CaF2) = Ка/(γСа 2+ γF-2),
поэтому выражение для определения растворимости фтора можно представить в виде:
[ F-] = [2Ка/(γСа 2+ γF-2)]1/3.
Необходимо:
− определить константу равновесия процесса растворения в стандартных условиях при Т=298К, значение которой не зависит от содержания других ионов в растворе;
− рассчитать значения коэффициентов активности ионов кальция и фтора, которые зависят от ионной силы раствора и могут отличаться для случаев «а» и «б», определяемых условиями задачи.
Значение константы равновесия реакции растворения флюорита определим из термодинамических данных:
ln Kа = − ΔG0реакц/(RT).
Значение ΔG0реакц определим из выражения:
ΔG0реакц = ∑ΔG0прод −∑ΔG0реаг;
ΔG0реакц = ΔG0обр(Сa2+) + 2 ΔG0обр(F-) - ΔG0обр(CaF2) =
-552,7 + 2 (-280,0) - (-1168,5) = 55,8 кДж/моль = 55,8 ·103 Дж/моль.
ln Kа = -55,8 10 /(8,314 298) = -9,78.
Kа = 1,66 · 10-10.
Для расчета коэффициентов активности ионов в растворе воспользуемся уравнениями Дебая-Хюккеля:
lgγi = -0,51ziI1/2, если I < 0,01;
lgγi = -0,51ziI1/2/(1 + I1/2), если 0,01 < I < 0,1;
где zi − заряды соответствующих ионов; I − ионная сила раствора, которая равна
I =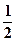 ∑(Ci ·zi2), где Ci − концентрации ионов, присутствующих в растворе(моль/л).
∑(Ci ·zi2), где Ci − концентрации ионов, присутствующих в растворе(моль/л).
Определим значения коэффициентов активности ионов кальция и фтора для случая «а», когда в растворе присутствуют только ионы кальция и фтора, образовавшиеся при растворении флюорита. Поскольку ионная сила раствора не известна проведем определение коэффициентов активности методом последовательных приближений. На первом шаге операции примем значения коэффициентов активности ионов кальция и фтора равными единице:
γСа 2+ = 1 и γF-2 = 1.
В этом случае концентрация ионов фтора в растворе составит:
[ F-] =(2Ка)1/3;
[ F-] = (2 · 1,66 ·10-10)1/3 = 0,69 10-3 моль/л.
Концентрация ионов кальция будет равна:
[Ca2+] = [ F-]/2 = 0,69 · 10-3 /2 = 0,34 · 10-3 моль/л.
При таких концентрациях ионов кальция и фтора ионная сила раствора составит:
I = 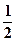 ∑(Ci ·zi2) =
∑(Ci ·zi2) = 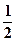 ([Ca2+]·22 + [ F-]·12) =
([Ca2+]·22 + [ F-]·12) = 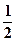 (0,34 ·10-3 ·4 + 0,69 ·10-3) = 2,05 ·10-3 < 0,01.
(0,34 ·10-3 ·4 + 0,69 ·10-3) = 2,05 ·10-3 < 0,01.
При такой ионной силе раствора коэффициенты активности ионов кальция и фтора составят:
γF-2 = 0,95. lg γСа 2+ = -0,51· 4 · (2,05 ·10-3)1/2 =-0,091; γСа 2+ = 0,81;
lgγF-2 = -0,51 · 1 · (2,05 ·10-3)1/2 = -0,0223;
При таких значениях коэффициентов активности ионов кальция и фтора концентрации ионов в растворе составят:
[ F-] = [2Ка/(γСа 2+ γF-2)]1/3 = [2 · 1,66 · 10-10 /(0,81 · 0,952)]1/3 = 0,77· 10-3 моль/л;
[Ca2+] = [ F-]/2 = 0,38 ·10-3 моль/л.
Полученные значения концентраций существенно отличаются от значений, полученных на предыдущем шаге, поэтому продолжим расчет.
Ионная сила раствора при концентрациях ионов кальция и фтора, равных соответственно 0,38 ·10-3 и 0,77·10-3 моль/л в отсутствие других ионов составит:
I = 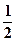 (0,38·10-3· 4 + 0,77·10-3·1) = 1,14 ·10-3.
(0,38·10-3· 4 + 0,77·10-3·1) = 1,14 ·10-3.
Определим коэффициенты активности ионов кальция и фтора при такой ионной силе раствора:
lg γСа 2+ = -0,51· 4 · (1,14 ·10-3)1/2 = -0,069; γСа 2+ = 0,85;
lgγF-2 = -0,51 · 1 · (1,14 ·10-3)1/2 = -0,0173; γF-2 = 0,96.
При этих значениях коэффициентов активности ионов кальция и фтора их концентрации в растворе фторида кальция составят:
[ F-] =[2Ка/(γСа 2+ γF-2)]1/3 = [2 · 1,66 · 10-10 /(0,85 · 0,962)]1/3 = 0,74 · 10-3 моль/л;
[Ca2+] = [ F-]/2 = 0,37 ·10-3 моль/л.
Полученные значения концентраций ионов отличаются от значений, полученных на предыдущем шаге расчетов (когда коэффициенты активности были приняты равными единице), менее чем на 10%. В нашем случае такую разницу можно читать удовлетворительной и не проводить дальнейших шагов, приближающих к истинным значениям равновесных концентраций ионов кальция и фтора в растворе.
Таким образом, можно принятья, что концентрация ионов фтора при стандартных условиях и Т=298 К и в отсутствие других ионов, при равновесии с флюоритом составит 0,74·10-3 моль/л. Поскольку молярная Мааса фтора равна 19 г/моль, концентрация ионов фтора составит:
СF- = [ F-] ·М (F-) · 103 = 0,74 ·10-3 · 19 ·103 = 14 мг/л.
Это значение более чем в 18 раз превышает значение ПДКр.х. для ионов фтора:
n = 14/0,75 = 18,7.
Рассмотрим случай «б», когда в исходной воде присутствует хлорид натрия. В этом случае помимо ионов кальция и фтора, образующихся при диссоциации флюорита, в растворе присутствуют ионы натрия и хлора, образующиеся при растворении хлорида натрия: NaCl → Na+ + Cl-.
Для расчета коэффициентов активности ионов кальция и фтора методом итераций примем на первом шаге концентрации ионов кальция и фтора равными значениям, рассчитанным для случая «а», когда другие ионы в растворе отсутствовали:
[Ca2+] = 0,37 ·10-3 моль/л;
[ F-] = 0,74 · 10-3 моль/л.
Поскольку хлорид натрия относится к сильным электролитам, он практически полностью диссоциирует в водном растворе. Поэтому концентрации ионов хлора и натрия в растворе по условию задачи составят:
[Na+] = [Cl-] = 0,05моль/л.
Ионная сила в таком створе будет равна:
I = 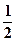 ∑(Ci ·zi2) =
∑(Ci ·zi2) = 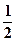 ([Ca2+]·22 + [ F-]·12 + [Na+] ·12 + [Cl-] ·12) =
([Ca2+]·22 + [ F-]·12 + [Na+] ·12 + [Cl-] ·12) = 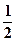 (0,37 · 10-3 · 4 + 0,74 ·10-3 + 0,05 + 0,05) = 5,1 · 10-2.
(0,37 · 10-3 · 4 + 0,74 ·10-3 + 0,05 + 0,05) = 5,1 · 10-2.
Поскольку 0,01 < 0,051 < 0,1, для определения коэффициентов активности ионов кальция и фтора воспользуемся уравнением:
lgγi = -0,51ziI1/2/(1 + I1/2).
Значения коэффициентов активности ионов кальции и фтора в этом случае составят:
lg γСа 2+ = -0,51· 4 · (5,1 ·10-2)1/2/ [1 +(5,1 ·10-2)1/2] = -0,376; γСа 2+ = 0,421;
lgγF-2 = -0,51 · 1 · (5,1 ·10-2)1/2 [1 +(5,1 ·10-2)1/2] = -0,939; γF-2 = 0,805.
При таких значениях коэффициентов активности ионов фтора и кальция составят:
[ F-] = [2Ка/(γСа 2+ γF-2)]1/3 = [2 · 1,66 · 10-10 /(0,421 · 0,8052)]1/3 = 1,10 · 10-3 моль/л;
[Ca2+] = [ F-]/2 = 0,55 ·10-3 моль/л.
Для раствора с такими концентрациями ионов кальция и фтора, содержащего также по 0,05 моль/л ионов натри я и хлора ионная сила составит:
I = 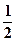 (0,55 · 10-3 · 4 + 1,10 ·10-3 +0,05 +0,05) = 5,1 · 10-2.
(0,55 · 10-3 · 4 + 1,10 ·10-3 +0,05 +0,05) = 5,1 · 10-2.
Ионная сила раствора практически не изменилась, поэтому не изменятся значения коэффициентов активности ионов кальция и фтора и их концентрации. Поэтому дальнейшие приближения при принятой точности вычислений не имеют смысла.
Таким образом, в растворе, содержащем ионы натрия и хлора в концентрации 0,05 моль/л, равновесное значение концентрации фторид-ионов составит:
[ F-] = 1,10 · 10-3 моль/л,что соответствует концентрации
СF- = [ F-] ·М (F-) · 103 = 1,10 · 10-3 · 19 · 103 = 20,9 мг/л.
Это значение почти в 28 раз превышает ПДКр.х. для ионов фтора:
n = 20,9/0,75 = 27,9 ≈ 28.
Ответ: концентрация ионов фтора в природной воде, находящейся в равновесии с флюоритом, не содержащим примесей, при нормальных условиях, когда в исходной воде отсутствуют растворенные примеси, составляет 14 мг/л, что в 19 раз превышает значение ПДр.х.. в случае, когда в исходной воде содержатся ионы натрия и хлора в концентрации 0,05М, содержание ионов фтора составляет 20,9 мг/л, что в 28 раз превышает значение ПДКр.х..
Какое значение pH следует ожидать в дождевой воде, находящейся в равновесии с атмосферным воздухом, содержащим в качестве примеси («активного компонента») лишь диоксид углерода в количестве 0,035%(об.)? На сколько единиц pH оно может измениться при прогнозируемом увеличении содержания CO в атмосферном воздухе в два раза? Примите температуру воздуха равно 298 К, давление − 101,3 кПа, парциальное давление паров воды − 3,12 ·10-3 атм.
Решение:
Процесс растворения диоксида углерода в воде, приводящий к появлению ионов водорода и, следовательно, к изменению pH воды, может быть представлен уравнением:
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3-.
Константа равновесия диссоциации угольной кислоты по первой ступени равна:
К1 = а(H+)а(HCO3-)/ а(H2CO3).
Диссоциация угольной кислоты по второй ступени протекает значительно слабее и приводит к появлению карбонат-ионов:
HCO3- ↔ H+ + CO32-
Константа диссоциации угольной кислоты по второй ступени имеет вид:
К2 = а(H+)а(CO32-)/а(HCO3-).
Константа диссоциации угольной кислоты по второй ступени примерно на четыре порядка меньше, чем константа диссоциации по первой ступени, поэтому при оценке влияния угольной кислоты на значение pH атмосферных осадков процесс диссоциации по второй ступени можно не принимать во внимание.
При диссоциации угольной кислоты по первой ступени концентрации образующихся гидрокарбонат-ионов и ионов водорода равны между собой. Поскольку рассматриваемый раствор имеет низкую концентрацию ионов, можно принять, что коэффициенты активности ионов H+ и HCO3- равны единице. Поэтому и активности этих ионов равны их концентрациям, а выражение для К1 можно представить в виде:
К1 = [H+]2 / [H2CO3].
Под концентрацией H2CO3 обычно подразумевают концентрацию растворенного диоксида углерода, которая в соответствии с законом Генри равна:
[CO2]р-р = KГ (CO2) P(CO2),
где [CO2]р-р − концентрация растворенного диоксида углерода, моль/л; KГ (CO2) − константа Генри для углекислого газа, моль/(л·атм); P(CO2) − парциальное давление диоксида углерода в воздухе, Па(атм).
Учитывая это, уравнение для К можно переписать в виде:
К1 = [H+]2 / [H2CO3] = [H+]2 /[CO2]р-р
К1 = [H+]2 /[KГ (CO2) P(CO2)].
Из полученного уравнения легко вывести зависимость концентрации ионов водорода от парциального давления диоксида углерода в атмосферном воздухе:
[H+] = [K 1KГ(CO2)P(CO2)]1/2,
pH раствора, находящегося в контакте с воздухом, содержащим диоксид углерода
pH = − lg[H+] = − lg[K 1KГ(CO2)P(CO2)]1/2.
Необходимые для расчета значения константы диссоциации угольной кислоты по перовой ступни и константы Генри для диоксида углерода, которые зависят от температуры процесса, можно найти в справочной литературе:
K1 = 4,45 ∙ 10-7 моль/л;
KГСO2) = 3,3 ∙ 10-2 моль/(л ∙ атм).
Парциальное давление диоксида углерода можно рассчитать, зная его концентрацию в воздухе, общее давление и давление паров воды в системе. В настоящее время парциальное давление диоксида углерода составляет:
P(CO2) =[Pобщ – P(H2O)] ∙ φ(CO2) =
=(1 – 3,12 ∙ 10-3) ∙ 0,035/100 = 3,5 ∙ 10-4 атм.
При увеличении содержания диоксида углерода в воздухе в два раза его парциальное давление удвоится и составит:
P*(CO2) = 7,0 ∙ 10-4атм.
В настоящее время pH атмосферных осадков при присутствии в воздухе только диоксида углерода составляет:
pH = -lg(4,45 ∙ 10-7 ∙ 3,3 ∙ 10-2 ∙ 3,5∙10-4) = 5,6.
При удвоении содержания диоксида углерода в воздухе pH атмосферных осадков составит:
pH* = -lg(4,45 ∙ 10-7 ∙ 3,3 ∙ 10-2 ∙ 7,0 ∙10-4) = 5,5.
Изменение pH составит:
ΔpH = pH – pH* = 5,6 -5,5 = 0,1
Ответ: в настоящее время pH атмосферных осадков при присутствии в воздухе в качестве примеси только CO2 должен составлять 5,6. При удвоении содержания CO2 pH дождевой воды изменится на 0,1 единиц pH и составит 5,5.
Какое значение pH следует ожидать у дождевой воды, находящейся в равновесии с атмосферным воздухом, содержащим 0,035%(об.) диоксида углерода, 1млрд-1 диоксида серы и 1млрд-1 аммиака? Температура воздуха равна 298 К, давление 101,3 кПа, парциальное давление паров воды принять равным 3,16 кПа. Какой вклад вносят эти примеси в процесс закисления дождевой воды?
Решение:
Процессы растворения в дождевой воде диоксида углерода, диоксида серы и аммиака моно представить следующими брутто-уравнениями:
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3-,
SO2 + H2O ↔ H+ + HSO3-,
NH3 + H2O ↔ OH- + NH4+
Для этих процессов можно рассчитать концентрации образующегося иона водорода (гидроксила − для случая растворения аммиака) по уравнению:
[H+] = [K1iKГi Pi]1/2
или− при растворении аммиака −
[OH-] = [K(NH4OH) KГ(NH3) P(NH3)]1/2,
где K1i и K(NHOH) − константы диссоциации угольной и сернистой кислот по первой ступени и гидроксида аммония соответственно; KГi и KГ(NH3) − константы Генри для парциальные давления диоксида углерода или диоксида серы и аммиака соответственно.
Константы диссоциации кислот и гидроксида аммония, а также значения соответствующих констант Генри приводятся в справочной литературе; при298 К значения этих величин равны: K1(H2CO3) = 4,45 ∙10-7моль/л KГ (CO2) = 3,3 ∙ 10-2 моль/(л ∙ атм);
K1 (H2SO3 ) = 2,7 ∙ 10-7моль/л; KГ (SO2) = 5,34 моль/(л ∙ атм);
K(NH 4OH) = 1,8 ∙ 10-5 моль/л; KГ (NH3) = 89,1 моль/(л ∙ атм).
Парциальные давления примесей можно рассчитать, зная их концентрации, общее давление и давление паров воды в воздухе. Однако следует учесть, что:
− концентрации диоксида серы и аммиака выражены в млрд-1, поэтому для их перевода в объемные доли необходимо умножить соответствующее значение концентрации на 10-9;
− концентрация диоксид углерода выражена в %(об.), поэтому для перевода в объемные доли необходимо умножить соответствующее значение концентрации на 10 -1
−общее давление смеси, давление паров воды и значения соответствующих констант Генри приведены в различных единицах измерения давления; для выражения их в одних и тех же единицах в данном случае достаточно разделить значение давления, выраженное в кПа, на 101,3.парциальные давления соответствующих примесей в воздухе составят:
Pi =[Pобщ – P(H2O)] ∙ φi;
P(CO2) =[Pобщ – P(H2O)] ∙ φ(CO2) = (101,3 – 3,16) 0,035 ∙ 10-2 /101,3 =33,9 ∙ 10-5 атм.
P(SO2) =[Pобщ – P(H2O)] ∙ φ(SO2) = (101,3 – 3,16) 1 ∙ 10-9 /101,3 = 9,69 ∙ 10-10 атм.
P(NH3) =[Pобщ – P(NH3] ∙ φ(NH3) = (101,3 – 3,16) 1 ∙ 10-9 /101,3 = 9,69 ∙ 10 -10 атм.
Концентрации ионов водорода, образующихся при растворении диоксида углерода [Н+]1 и диоксида серы [Н+]2, составят:
[Н+]1 = (4,45 ∙ 10-7 ∙ 3,3 ∙ 10-2 ∙ 33,9 ∙ 10 -10)1/2 = 2,23 ∙10-6 моль/л;
[Н+]2 = (2,7 ∙ 10-2 ∙ 5,34 ∙ 9,69 ∙10-10)1/2 = 1,18 ∙ 10-5 моль/л.
Концентрация ионов гидроксила, образующихся при растворении аммиака, составит:
[OH-] = (1,6 ∙ 10-5 ∙ 89,1 ∙ 9,69 ∙ 10-10)1/2 = 1,17∙ 10-6моль/л.
Ионы гидроксила, образующиеся при растворении аммиака, могут связывать ионы водорода с образованием молекул воды:
H+ + OH- = H2O.
Поэтому для определения общего содержания ионов водорода в растворе следует сложить концентрации ионов водорода, образующихся при растворении диоксида углерода и диоксида серы, и вычесть концентрацию ионов гидроксила, образующихся при растворении аммиака. Общее содержание ионов водорода в растворе составит:
[H+]общ = [Н+]1 + [Н+]2 −[OH-] = 2,23 ∙10-6 + 1,18 ∙10-5 − 1,17 ∙10-6 + 1,29 ∙10-5 моль/л.
Значение pH этого раствора составит:
pH = -lg[H+]общ = 4,9.
Вклад каждой из примесей в процесс закисления природной воды можно определить по их %-ной доле в общей концентрации ионов водорода, взятой с соответствующим знаком:
αi= + [Н+]i 100/[H+]общ (%);
α(CO2) = 2,23∙ 10-6∙ 100/ (1,29 ∙10-5) = +17%,
α(SO2) = 1,18 ∙10 ∙100/(1,29 ∙10-5) = +91%,
α(NH3) = −[1,17 ∙10∙100/(1,29 ∙10-5)] = −9,1%.
Ответ: раствор будет иметь значение pH = 4,9; вклад примесей в процесс закисления составит: диоксида углерода − (+)17%, диоксида серы −(+)91%, аммиака − (−)9,1%
Проба природной воды имеет щелочность,равную 1,1 ммоль/л; значение pH этой воды равно 6; температура 298К. Оцените концентрации компонентов карбонатной системы в данной пробе. Каким будет парциальное давление диоксида углерода в воздухе, находящемся в равновесии с этой водой? Какими будут концентрации компонентов карбонатной системы в этой воде, если контакт с воздухом будет нарушен (прекратится поступление CO2), а в результате протекания фотосинтеза pH станет равным 10? Процессов осаждения или растворения карбонатов в системе не происходило. Принять коэффициенты активности компонентов карбонатной системы равными единице.
Решение:
По условию задачи предлагается оценить концентрацию компонентов карбонатной системы ([CO2]р-р, [HCO3-], [CO3-2]) при двух значениях pH.
Рассмотрим первый случай: pH = 6. Концентрация ионов водорода в этом растворе равна 10-6 моль/л. В соответствии с распределительной диаграммой в этом случае в растворе практически отсутствуют карбонат-ионы. Концентрация ионов гидроксила, которую можно оценить из ионного произведения воды тоже очень низкая ([OH-] = 10-14 /10-6 = 10-8 моль/л)., поэтому щелочность раствора практически полностью связана с присутствием в растворе гидрокарбонат-ионов:
Щ = [HCO3-] = 1,1 ммоль/л = 1,1∙ 10-3 моль/л.
Помимо гидрокарбонат-ионов в растворе присутствует растворенный диоксид углерода. Его концентрацию легко найти из уравнения диссоциации угольной кислоты по первой ступени (К1 = 4,45 ·10-7 моль/л):
К1 = [H+] [HCO3-]/ [CO2]р-р,
[CO2]р-р = [H+] [HCO3-]/К1
[CO2]р-р = 10-6 ∙1,1∙ 10-3 /(4,45∙10-7) = 2,4 ∙10-3 моль/л.
Парциальное давление диоксида углерода в воздухе, находящемся в равновесии с этим раствором, можно найти, используя закон Генри:
[CO2]р-р = КГ(CO2) P(CO2),
P(CO2) = [CO2]р-р/ КГ(CO2).
Значение константы Генри для диоксида углерода при 298К равно КГ(CO2) = 3,3∙10-2 моль/(л∙ атм).
В рассматриваемом случае имеем:
P(CO2) = 2,4∙10-3∙3,3 ∙10-2 = 7,9∙10-5 (атм) = 8,0 Па.
Рассмотрим случай, когда в результате фотосинтеза pH раствора увеличился до 10. Концентрация ионов водорода в этом растворе равна 10-4 моль/л. В этом случае в растворе практически отсутствует растворенный диоксид углерода (см. распределительную диаграмму). Карбонатная система представлена гидрокарбонат- и карбонат-ионами, и для определения их концентраций необходимы два уравнения.
Первое уравнение можно получить из выражения щелочности раствора. В данном случае при определении щелочности следует учитывать все ее составляющие. Поскольку в системе отсутствовали процессы растворения или осаждения, величина щелочности системы не изменилась, и можно записать равенство:
Щ = [HCO3-] + 2[CO3-2] + [OH-] = 1,1∙10-3моль/л.
Концентрация ионов гидроксила равна:
[OH-] = 10-14/10-10 = 1 ·10-4 моль/л.
Подставив это значение в выражение щелочности, получим:
[HCO3-] + 2[CO3-2] = 1,1 ∙10-3 − 1 ∙10-4 = 1,0 ·10-3 моль/л.
В качестве второго уравнения, связывающего концентрации гидрокарбонат- и карбонат-ионов в растворе, можно взять выражение для константы диссоциации угольной кислоты по второй ступени:
K2 = [H+][HCO3-]/ [CO3-2] = 4,69 ·10-11.
В нашем случае, поскольку = 10 моль/л, получим равенство:
[HCO3-]/ [CO3-2] = 4,69 ∙ 10-11 /10-10 = 0,469.
Отсюда [HCO3-] = 0,469[CO3-2].
Подставив это равенство в полученное выражение для щелочности и выполнив необходимые преобразования и вычисления, получим значения концентрации карбонат-ионов:
[HCO3-] + 2[CO3-2] = 0,469 [CO3-2] + 2[CO3-2] = 2,469 [CO3-2] =1,0 ·10-3;
[CO3-2] = 4,05 ∙ 10-4моль/л.
Концентрация гидрокарбонат-ионов составит:
[HCO3-] = 0,469[CO3-2] = 0,469 ∙ 4,05 ·10-4 = 1,90 ∙10-4 моль/л.
Ответ: при pH=6 концентрации компонентов карбонатной системы составят: [CO2]р-р= 2,4 ·10-3 моль/л; [HCO3-] = 1,1 ∙ 10-3 моль/л; парциальное давление диоксида углерода в воздухе P(CO2) = 8,0 Па; при pH =10 концентрации компонентов карбонатной системы составят: [HCO3-] = 1,90 · 10-4моль/л; [CO3-2] = 4,05 ∙ 10-4 моль/л.
Какое количество мг/л органических соединений условной формулы {CHO} могло образоваться в водоеме в процессе фотосинтеза. Если был нарушен контакт с воздухом и карбонатными породами, растворения или выделения карбоната кальция не происходило? В исходном растворе с pH=6 щелочность воды составляла Щ = 1,1 ммоль/л. В процессе фотосинтеза pH увеличился до значения pH=10. Процесс протекал при нормальном давлении и температуре 298К.
Решение:
Процесс фотосинтеза протекающего в водоеме при отсутствии растворения диоксида углерода, может быть представлен упрощенным брутто-уравнением вида:
HCO3- + H2O + h
 {CH2O} + O2 + OH-.
{CH2O} + O2 + OH-.
Анализ этого уравнения показывает, что в процессе фотосинтеза при отсутствии растворения и осаждения происходит изменение в соотношении компонентов карбонатной системы, но щелочность раствора не меняется, поскольку на каждый прореагировавший гидрокарбонат-ион образуется один гидроксил-ион.
В начальный момент (при pH=6) все атомы углерода входят в состав неорганических соединений − компонентов карбонатной системы. В растворе, образовавшемся в процессе фотосинтеза, атомы углерода уже входят в состав не только компонентов карбонатной системы, но и в состав органических соединений. Следует обратить внимание на тот факт, что общее содержание атомов углерода в системе остается неизменным, поэтому можно написать равенство:

где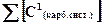 и
и  − суммарная концентрация атомов углерода в составе всех компонентов карбонатной системы (моль/л), образующихся в растворе при pH=6 и pH=10 соответственно;
− суммарная концентрация атомов углерода в составе всех компонентов карбонатной системы (моль/л), образующихся в растворе при pH=6 и pH=10 соответственно;  − концентрация атомов углерода (моль/л), связанных в процессе фотосинтеза в органические соединения.
− концентрация атомов углерода (моль/л), связанных в процессе фотосинтеза в органические соединения.
Отсюда количество атомов углерода, входящих в состав органических соединений составит:
 .
.
Зная общее количество атомов углерода, связанных в органические соединения в каждом литре воды, и зная молекулярную формулу синтезируемого органического соединения, легко найти его массу:
m(орг. соед) = 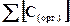 ∙M ∙103,
∙M ∙103,
где m(орг. соед.) − количество органического соединения, синтезируемого в каждом литре воды, мг/л; 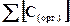 − концентрация атомов углерода, связанных в процессе фотосинтеза в органическое соединение, моль/л; M − молярная масса органического соединения, г/моль; 103 − коэффициент перевода массы из г в мг.
− концентрация атомов углерода, связанных в процессе фотосинтеза в органическое соединение, моль/л; M − молярная масса органического соединения, г/моль; 103 − коэффициент перевода массы из г в мг.
Таким образом, для решения задачи необходимо найти суммарную концентрацию компонентов карбонатной системы при pH=6 и pH=10.
Как было показано в при мере 5.8 при pH=6 в карбонатной системе присутствуют лишь гидрокарбонат-ионы и молекулы растворенного диоксида углерода, а их концентрации при щелочности раствора, равной 1,1 ммоль/л, составляют:
мере 5.8 при pH=6 в карбонатной системе присутствуют лишь гидрокарбонат-ионы и молекулы растворенного диоксида углерода, а их концентрации при щелочности раствора, равной 1,1 ммоль/л, составляют:
[HCO3-] = 1,1∙ 10-3моль/л,
[CO2]р-р = 2,4 10-3моль/л.
При pH=10 карбонатная система представлена лишь гидрокарбонат- и карбонат-ионами, а их концентрации при щелочности раствора, равной 1,1 ммоль/л, равны:
[HCO3-] = 1,90 ∙ 10-4 моль/л,
[CO3-2] = 4,05 ∙10-4 моль/л.
Поскольку в каждом из компонентов карбонатной системы содержится лишь один атом углерода, суммарная концентрация атомов углерода, связанных с компонентами карбонатной системы, будет равна сумме концентраций компонентов, выраженных в моль/л:
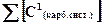 = [HCO3-] + [CO2]р-р = 1,1 ∙10-3 + 2,4 ∙ 10-3 = 3,5 -3 моль/л,
= [HCO3-] + [CO2]р-р = 1,1 ∙10-3 + 2,4 ∙ 10-3 = 3,5 -3 моль/л,
 = [HCO3-] + [CO3-2] = 1,90 ∙10-4 + 4,05 ∙10-4 = 5,95 ∙10-4 моль/л.
= [HCO3-] + [CO3-2] = 1,90 ∙10-4 + 4,05 ∙10-4 = 5,95 ∙10-4 моль/л.
Отсюда концентрация атомов углерода, связанных в органические соединения, составит:
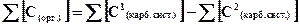 = 3,5 ∙10-3 − 5,95 ∙10-4 = 2,91∙10-3моль\л.
= 3,5 ∙10-3 − 5,95 ∙10-4 = 2,91∙10-3моль\л.
Поскольку по условию задачи в воде синтезировалось лишь органическое соединение общей формулой CH2O, молярная масса которого составляет 30 г/моль, количество органических соединений, синтезированных в каждом литре воды, составит:
m(орг. соед.) = 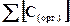 ∙M ∙103 = 2,91 10 30 10 = 87 мг/л.
∙M ∙103 = 2,91 10 30 10 = 87 мг/л.
Ответ: в водоеме могло образоваться 87 мг/л органических соединений общей формулы CH2O.
На какую максимальную глубину может опуститься уровень природного известнякового плато за 100 лет за счет растворения карбоната кальция в выпадающей на плато дождевой воде, если дождевая вода полностью стекает с поверхности плато, но лишь после установления равновесия между дождевой водой, атмосферным воздухом и карбонатом кальция? Уровень осадков, выпадающих ежегодно на плато в течение 100 лет, принять одинаковым и равным 800 мм/год. Температура все время составляла 298К, давление − 101,3 кПа, концентрация диоксида углерода в атмосферном воздухе − 0,035%(об.), парциальное давление паров воды − 3,16 кПа. Плотность известняка принять равной 2,7 г/см3. В качестве «активной» примеси в воздухе присутствует только диоксид углерода.
Решение:
Уменьшение уровня поверхности известнякового плато произойдет вследствие растворения карбоната кальция в дождевой воде. Этот процесс можно представить уравнением реакции:
CaCO3 + CO2(р-р)  Ca2+ + 2 HCO3-.
Ca2+ + 2 HCO3-.
Концентрация ионов кальция в воде при равновесии с карбонатом кальция (известняковое плато) и диоксидом углерода, содержащимся в атмосферном воздухе, определяется уравнением:
[Ca2+] (моль/л) =  ,
,
где P(CO2) − парциальное давление диоксида углерода, атм; KГ(CO2) − константа Генри для CO2, моль/(л∙ атм); K(CaCO3) − константа равновесия, устанавливающегося при растворении кальцита; K1, K2 − константы диссоциации угольной кислоты по первой и второй ступени соответственно.
Процесс растворения карбоната кальция при отсутствии контакта с диоксидом углерода описывается уравнением:
CaCO3  Ca2+ + CO32-.
Ca2+ + CO32-.
Константа равновесия этого процесса может быть представлена уравнением:
K(CaCO3) = а(Ca2+)a(CO32-).
Численное значение этой константы можно определить по уравнению изотермы химической реакции для стандартных условий:
lnKa = −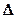 G0реакц
G0реакц /RT.
/RT.
Значение 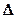 G0реакц можно определить из уравнения:
G0реакц можно определить из уравнения:
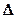 G0реакц =
G0реакц = 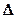 G0прод −
G0прод − 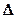 G0реаг;
G0реаг;
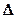 G0реакц =
G0реакц = 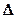 G0обр(Ca2+) +
G0обр(Ca2+) + 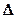 G0обр (CO32-) −
G0обр (CO32-) − 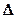 G0обр(CaCO3) =
G0обр(CaCO3) =
= −557,2 + (−527,6) − (−1128,4) = 48,1 кДж/моль = 48,1 ∙ 103 Дж/моль.
lnKa = −48,1∙ 103/(8,314 ∙ 298) = −19,41;
Ka = K(CaCO3) = 3,9 ∙ 10-9.
Парциальное давление диоксида углерода легко найти по общему давлению в системе и концентрации диоксида углерода в воздухе:
P(CO2) = (Pобщ − PH2O) ∙ (CO2) = (101,3 – 3,16) ∙ 0,035∙10-2 = 3,39∙10-2 кПа = 3,39∙10-4атм.
(CO2) = (101,3 – 3,16) ∙ 0,035∙10-2 = 3,39∙10-2 кПа = 3,39∙10-4атм.
Подставив в уравнение для расчета концентрации ионов кальция константы, получим:
[Ca2+] =  ;
;
[Ca2+] = 4,69∙10-4моль/л = 0,469 моль/м3.
Объем дождевой воды, который выпадает на каждый квадратный метр поверхности плато за сто лет, можно определить по уравнению:
V = 100 H,
где V − объем дождевой воды, выпадающий на каждый квадратный метро плато за 100 лет, м/м; H − ежегодный уровень атмосферных осадков, м3/(м2∙ год), или м/год
Поскольку по условию задачи H =.800 мм = 0,8м, а каждый квадратный метр плато
за 100 лет составит:
V = 100 ∙ 0,8 = 80 м3/м2.
Общее количество карбоната кальция, переходящее в раствор с поверхности плато, рано количеству ионов кальция в дождевой воде после установления равновесия. Поэтому общее количество карбоната кальция, растворившееся за 100 лет на каждом квадратном метре плато, составит:
ν (CaCO3) = V∙ [Ca2+] ∙ 103 = 80∙ 0,469 = 37,52 моль/м2 за 100 лет.
Масса карбоната кальция, растворившегося за 100 лет на каждом квадратном метре плато, − m(CaCO3) − составит:
m(CaCO3) = 37,52 ∙100 = 3752 г/м2 за 100 лет.
Объем карбоната кальция, растворившегося за 100 лет на каждом квадратном метре плато, можно найти, зная плотность кальцита. По условию плотность кальцита равна 2,7 г/см3 или 2,7 ∙ 10 6 кг/м3. Поэтому объем растворившегося кальцита, будет равен:
V(CaCO3) = 3752/(2,7 ∙106) = 1,39 ∙10-3 м3/м2 за 100 лет.
Уровень, на который опустится каждый квадратный метр плато за 100 лет, составит:
h = V(CaCO3)/S = 1,39 ∙ 10-3/1 = 1,39 ∙ 10-3 м.
Ответ: уровень известнякового плато может опуститься в результате процесса растворения карбоната кальция за 100 лет на 1,4 мм.
Какое парциальное давление кислорода должно соответствовать редокс-уровню системы, в которой протекает анаэробный процесс восстановления диоксида углерода до метана (pe- = − 4,2), при наступлении равновесия, если pH раствора равен 7?
Решение:
При установлении равновесия в системе редокс-потенциалы всех окислительно-восстановительных реакций равны друг другу. Поэтому окислительно-восстановительный потенциал реакции, определяющей верхнюю границу устойчивости воды, будет равен окислительно-восстановительному потенциалу реакции восстановления диоксида углерода:
pe- = 20,8 +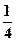 lgP(O2) − pH = 4,2.
lgP(O2) − pH = 4,2.
Из этого равенства легко найти P(O2); при pH=7 получим:
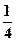 lgP(O2) = −4,2 − 20,8 + pH = −4,2 − 20,8 + 7 = 18,0.РHHРHH
lgP(O2) = −4,2 − 20,8 + pH = −4,2 − 20,8 + 7 = 18,0.РHHРHH
lgP(O2) = −72; P(O2) = 10-72 атм.
Ответ: парциальное давление кислорода в воздухе P(O2) = 10-72 атм.
Какой минимальный объем природной воды необходим для растворения сероводорода, образовавшегося при окислении 10 г сахара в процессе сульфат- редукции, если весь выделившийся сероводород переходит в раствор, в котором концентрация H2S не превышает значений подпороговой концентрации, определяемой по запаху (ППКорг = 0,05 мг/л)? Молекулярная формула сахарозы С12H22O11.
Решение:
В процессе сульфат-редукции при окислении органического вещества происходит образование сероводорода по реакции:
2Cорг + SO42- + 2 H2O  H2S + 2 HCO32-.
H2S + 2 HCO32-.
На каждые два моля углерода, связанных в органическое соединение, образуется молекула сероводорода.
Количество молей углерода (NC), содержащихся в m г органических соединений, имеющих молярную массу Mорг и содержащих n атомов углерода в каждой молекуле органического соединения, можно определить по уравнению:
NC = mn/Mорг.
Согласно условию задачи количество углерода, содержащихся в 10г сахара составит:
NС =10 ∙ 12/342 = 0,35 моль.
В процессе сульфат–редукции этого количества углерода может образоваться N(H2S) молей сероводорода:
N(H2S) = ½ NC = 0,175 моль.
Масса образующегося сероводорода составит:
m(H2S) = N(H2S) ∙ M(H2S) = 0,175 ∙34 ∙103 = 5950 мг.
Объем природной воды, необходимый для растворения этого количества сероводорода при конечной концентрации ниже ППКорг, составит:
V = M(H2S) /ППКорг = 5959/0,05 = 120000 л = 120 м3.
Ответ: необходимый минимальный объем природной воды равен 120м3.
Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Р е ш е н и е. В 1 л воды содержится 202,5: 500 = 0,405 г Са(НСО3)2, что составляет 0,405: 81 = 0,005 эквивалентных масс или 5 мэкв (81 г / моль – эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5 мэкв / л.
Рассчитать общую жесткость воды (ммоль/л, градусы), если в 0,25 л воды содержится 16,20 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 3,50 мг хлорида магния.
Р е ш е н и е. Один градус жесткости соответствует содержанию 1 г СаО в 100 г воды. Содержание других металлов пересчитывается на количество эквивалентов СаО. Воду, жесткость которой равна до 4 ммоль/л, считают мягкой, свыше 12 ммоль/л очень жесткой.
Выразим жесткость воды (ммоль/л) двухзарядных катионов металлов Са+2, Мg+2, Fe+2 и соответствующих их солей, содержащихся в 1 л воды:
Ж = [m1 / (M1 ∙ V)] + [m2 / (M2 ∙V)] + [m3 / (M3 ∙ V) +...,
где m1, m2, m3 массы двухзарядных катионов металлов (или соответствующим им солей) в воде, мг; М1, М2, М3 молярные массы эквивалентов катионов металлов (или соответствующих им солей); V объем воды, л.
Определяем молярные массы эквивалентов солей, обусловливающих жесткость воды:
1) Са(НСО3)2
МСа(НСО3)2 / 2 = 162,11 / 2 = 81,05 мг/моль;
2) СаСl2
МСаСl2 / 2 = 110,99 / 2 = 55,49 мг/моль;
3) Мg(HCO3)2
МMg (HCO3)2 / 2 = 146,34 / 2 = 73,17 мг/моль;
4) ММgCl2 / 2 = 95,21 / 2 = 47,60 мг/моль
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости и обусловливается содержанием в ней солей, придающих ей жесткость:
Жобщ = [16,20 / (81,05 ∙0,25)] + [2,92 / (73,17 ∙ 0,25)] + [11,10 / 55,49 ∙ 0,28)] + [9,50 / (47,60 ∙ 0,25) = 0,8 + 0,16 + 0,8 + 0,8 = 2,56 ммоль/л
Один градус жесткости соответствует 0,357 ммоль катионов двухзарядных металлов. Общая жесткость образца воды в градусах жесткости равна 2,560: 0,357 = = 7,17о. Вода данного образца считается мягкой.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2534; Нарушение авторских прав?; Мы поможем в написании вашей работы!