
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 13. Химические источники тока
|
|
|
|
Общее определение и понятие химического источника электрохимической энергии. Необратимые и обратимые гальванические элементы. Медно-цинковый гальванический элемент. Источники тока с электродами из различных металлов, концентрационные цепи, гальванические элементы с газовыми электродами. Аккумуляторы кислотные, щелочные, сухие аккумуляторные батареи. Топливные элементы.
Зависимость электродного потенциала от природы веществ учитывается величиной φ0. В связи с этим все электродные процессы принято располагать в ряд по величине их стандартных электродных потенциалов. Они для многих веществ измерены экспериментально и даны в справочниках.
Если расположить химические элементы в порядке относительной величины их стандартных электродных потенциалов, то получится ряд напряжений металлов или электрохимический ряд напряжений.
Общее определение и понятие химического источника электрохимической энергии. Гальванические элементы и химические источники тока (ХИТ). Необратимые и обратимые гальванические элементы.
Устройства, в которых осуществляется непосредственно преобразование энергии химической реакции в электрохимическую энергию называют химическими источниками электрической энергии или химическими источниками тока (ХИТ), или гальваническими элементами (ГЭ). Обычно гальваническими элементами называют такие ХИТ, в которых протекают практически необратимые реакции. Их нельзя перезаряжать, и они однократного действия.
ХИТ, в которых протекают обратимые (или почти обратимые) реакции, называют аккумуляторами.
Гальванический элемент – устройство, в котором создается электродвижущая сила (э.д.с.) в результате протекания химической реакции на его электродах, погруженных в раствор электролита. Гальванический элемент состоит из двух полуэлементов. В одном осуществляется окислительная полуреакция в другом восстановительная. Таким образом, действие гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. Однако устройство гальванического элемента таково, что окислительно-восстановительная реакция пространственно разделена. Окисление протекает на одном электроде, обычно металлическом, а восстановление на другом. При таких конструктивных условиях электроны передаются от восстановителя к окислителю по внешней цепи. Этот направленный поток электронов – есть электрический ток. При протекании окисления на одном электроде и восстановления на другом будет постоянно генерироваться электроны во внешнюю цепь, если ее замкнуть.
Медно-цинковый гальванический элемент или гальванический элемент Даниэля – Якоби.
Классическим примером гальванического элемента является элемент Даниэля – Якоби или медно-цинковый гальванический элемент (рис. 2). Один из его полуэлементов состоит из цинкового электрода, погруженного в раствор сульфата цинка. Другой элемент состоит из медного электрода, опущенного в раствор сульфата меди. Оба раствора соприкасаются, но не перемешиваются друг с другом, за счет пористой мембраны между разными электролитами.
В левом полуэлемене происходит окисление цинка
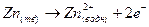 (1).
(1).
Так как на аноде всегда окисление, то цинковый электрод является анодом.
В правом полуэлементе происходит восстановление ионов меди
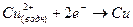 (2).
(2).
Важно, что обе полуреакции протекают в месте соприкосновения цинка с раствором.
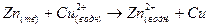 (3).
(3).
Электроны непосредственно переходят от атомов цинка к ионам меди. Но так как в данной окислительно-восстановительной реакции, окислительная полуреакция пространственно отдалена от восстановительной, то электроны будут переходить от восстановителя к окислителю не через раствор, а по внешней цепи, по проводнику, например, металлическому.
Поэтому на катоде будет происходить восстановление ионов меди в соответствии с реакцией
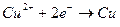 (4),
(4),
а на аноде окисление атомов цинка
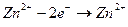 (5).
(5).

Рис. 2. Медно-цинковый гальванический элемент или элемент Даниэля-Якоби.
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. Цинковый электрод является анодом, заряженным отрицательно, медный электрод является катодом, заряженным положительно. В любом гальваническом элементе на аноде происходит процесс окисления, на катоде – процесс восстановления.
Солевой мостик и типы полуэлементов.
Гальванические элементы, используемые в лабораториях, состоят из двух полуэлеменов, разделенных солевым мостиком. Солевой мостик представляет собой перевернутую U-образную трубку, в которой находится солевой раствор (рис.2). Обычно в качестве такого раствора берут водные растворы NH4NO3, KNO3, KCl. Трубка с концов закрыта ватой. В элементе Даниэля-Якоби роль солевого мостика выполняет пористый стакан.
В электрохимических системах имеют место разные схемы подключения электродов.
Знаки электродов противоположны в ХИТ знаком анода и катода в электролитической ячейке (рис. 3).
Электролитическая ячейка Электрохимическая ячейка,
(э.д.с. прикладывается к ячейке) химический источник тока
(э.д.с. вырабатывается источником)
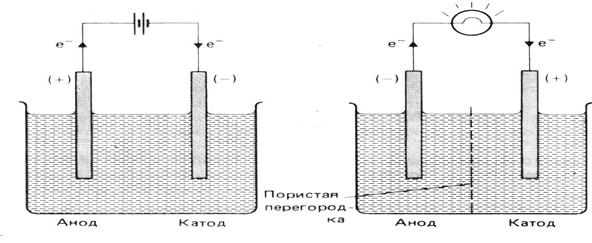
| Электролитическая ячейка (э.д.с. прикладывается к ячейке) | Электрохимическая ячейка – химического источника тока (э.д.с. вырабатывается источником) | |
| Анод Катод | Анод Катод | |
| Знак | + – | + – |
| Направление потока е- | во внешней цепи из внешней цепи | во внешней цепи из внешней цепи |
| Полуреакция | окисление восстановление | окисление восстановление |
Рис. 3. Схемы подключения электродов.
Обычно используют особые записи химического источника тока и гальванического элемента. Для гальванического элемента, показанного на рис. 1 можно записать
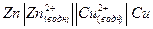 (6).
(6).
При такой записи используются следующие обозначения. Одна вертикальная черта │ означает поверхность раздела фаз металл-раствор. Две вертикальных черты ║ обозначают мембрану, пористую перегородку, пористый стакан или солевой мостик. Принято указывать в левой части анод (отрицательный электрод), то есть электрод, на котором происходит окисление, в правой части катод (положительный электрод) – электрод на котором происходит восстановление.
Типы полуэлементов.
Полуэлементы называют окислительно-восстановительными электродами, иногда окислительно-восстановительными парами. Наиболее распространенными являются следующие три полуэлемента: металл- ион металла, неметалл – ион, ион – ион.
Примером полуэлементов типа металл – ион металла являются электроды цинк – ион цинка и медь – ион меди (II). Примером полуэлемента неметалл – ион является водородный электрод. В таком полуэлементе между адсорбированным на твердой поверхности слоем молекул водорода и ионами гидроксония в растворе устанавливается равновесие:
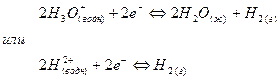 (7).
(7).
Схема водородного электрода
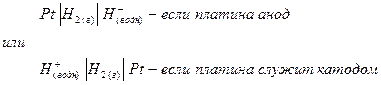
Полуэлемент типа ион – ион состоит из инертного электрода (например платины), погруженного в раствор, который содержит ионы одного и того же металла в двух разных состояниях окисления. Примером такого типа полуэлементов является система Fe3+ - Fe2+.
В этом полуэлементе устанавливается равновесие
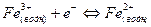 (8).
(8).
Схема полуэлемента запишется в виде:
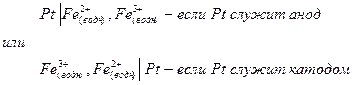
ЭДС гальванических элементов.
Электрический ток, протекающий во внешней цепи гальванического элемента, может производить полученную работу. Работа электрического тока выражается произведением количества, прошедшего по цепи электричества на напряжение
W=FU,
W – полученная работа; U – напряжение между полюсами гальванического элемента; F=96485 Кл/моль ≈ 96500 Кл/моль – количество электричества, прошедшее по цепи при окислении одной молярной масс эквивалентов ионов Ме1 и одновременном восстановлении одной молярной массы эквивалентов ионов Ме2.
Эта работа зависит от силы тока, также как и напряжение. В случае обратимого протекания реакции (ОВР), то есть при бесконечно маленькой скорости, напряжение будет максимальным, и работа тоже (рассеяние тепла от тока будет маленьким).
Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой гальванического элемента и обозначается E.
В общем случае при растворении (или выделении) 1 моль вещества, ионы которого имеют заряд n, максимальная полученная работа:
Wмакс =nFE.
Известно, что при Т=const, P=const
Wmax= –∆G,
где ∆G – изменение энергии Гиббса.
Поэтому можно записать
∆G= –nFE (9),
где Е - ЭДС.
Если соблюдаются стандартные условия, то ЭДС гальванического элемента называется его стандартным ЭДС, которое обозначается через Е0. Для него справедливо
∆G0= –nFE0 (10).
Учитывая, что стандартное изменение энергии Гиббса реакции связано с константой равновесия КС выражением вида
∆G0= –RTlnKC (11),
то имеем полезную для практических работ формулу
RTlnKC=nFE0 (12).
Данная формула позволяет измерением E0 (ЭДС) определить стандартную энергию Гиббса G0 и константу равновесия окислительно-восстановительных реакций.
Принято ЭДС гальванического элемента представлять как разность двух электродных потенциалов φ, каждый из которых отвечает полуреакции, протекающей на одном из электродом
Е=φк – φа (13),
где φк – потенциал катода, φа – потенциал анода.
Так как для электродных потенциалов имеет место уравнение Нернста
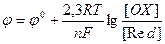 ,
,
то в силу (13), уравнение Нернста для ЭДС имеет следующий вид
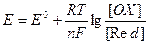 (14).
(14).
Сухие гальванические элементы.
Сухие гальванические элементы применяют в качестве источников питания для бытовой и радиоаппаратуры, переносных электрических фонарей. Все они имеют один и тот же принцип работы и различаются лишь химической природой электродов. Анодным электродом могут быть активные металлы Zn, Mg, Li, катодами – оксиды марганца, серебра, меди, хлориды свинца.
Среди сухих гальванических элементов самым распространенным является марганцево-цинковый элемент. Его условная запись имеет вид
(-) Zn │NH4Cl│C, MnO2 (+) (15).
В данном элементе анодом является цинковый электрод, катод изготовлен из смеси диоксида марганца с графитом. Смешивание диоксида марганца с графитом дает увеличение электрической проводимости. Электролитом является паста, состоящая из раствора хлорида аммония и загустителя - смеси муки с крахмалом.
На аноде и катоде рассматриваемого гальванического элемента, протекают следующие электродные реакции
(-) А: Zn → Zn2+ + 2e- (16)
(+) K: 2MnO2 + 2H2O + 2e- → MnO(OH) + 2OH (17).
При анодном окислении цинка образуется пленка труднорастворимого гидроксида
Zn2+ + 2OH- → Zn(OH)2 (18),
которая препятствует дальнейшему протеканию процесса на аноде. Поэтому для растворения гидроксида цинка применяют хлорид аммония, и в этом случае анодный процесс протекает по уравнению
2Zn + 4NH4Cl + 4OH- → [Zn(NH3)4]Cl2 + ZnCl2 + 4H2O + 4e- (19).
Суммарное уравнение токообразующей реакции имеет вид
2Zn + 4MnO2 + 4NH4Cl → 4MnO(OH) + ZnCl2 + [Zn(NH3)4]Cl2 (20).
Если заменить цинк магнием, имеющим меньшее значение стандартного электродного потенциала, то можно повысить напряжение сухого гальванического элемента. Также можно увеличить напряжение гальванического элемента, если использовать щелочной электролит, например, раствор KOH.
На основе сухих гальванических элементов выпускают батареи напряжением от 3 до 100 В, емкостью от 0,5 до 30 А∙час.
Недостатками сухих гальванических элементов является однократность использования и саморазрядка, понижающая напряжение и емкость.
Электрохимические аккумуляторы.
Аккумуляторами называют устройства, в которых происходит поэтапное преобразование электрической энергии в химическую, а также химической в электрическую. Они представляют собой агрегаты многоразового действия, сочетая в себе гальванический элемент и электролизер.
Процесс накопления химической энергии под действием вешнего постоянного тока называют зарядкой аккумулятора, а процесс превращения в электрическую энергию – зарядкой. При зарядке аккумулятор работает как электролизер, а при разрядке как гальванический элемент.
Рассмотрим свинцовые аккумуляторы, которые получили наибольшее распространение. Из свинца с примесью сурьмы отливают пластины ячеистой структуры. Их собирают в батареи и помещают в корпус из полипропилена. Предварительно в ячейки запрессовывают смесь оксида свинца (II) с глицерином, которая затвердевает в виде глицерата свинца. Свинцовые аккумуляторы называют также кислотными, так как электролитом в них является раствор серной кислоты. Оксид свинца (II) PbO при взаимодействии с H2SO4 превращается в сульфат свинца PbSO4, который при зарядке восстанавливается до свинца Pb на катоде и окисляется до оксида свинца (IV) PbO2 на аноде.
При разрядке аккумулятор работает как гальванический элемент. На его электродах протекают процессы
(-) А: Pb → Pb2+ + 2e- (21)
(+) K: PbO2 + 4H+ +2e- → Pb2+ + 2H2O (22).
Образующиеся катионы Pb2+ в среднекислотной среде связываются в малорастворимый сульфат свинца PbSO4, который оседает на поверхности электродов. С учетом этого электродные реакции имеют вид
(-) A: Pb(т) + SO42- (p) → PbSO4 (т) + 2е- (23)
(+) K: PbO2(т) + SO42- (р) + 4Н+(р) +2е- → 2PbSO4(т) + 2H2O (24).
Суммарная токообразующая реакция описывается уравнением
Pb(т) + PbO2(т) +2H2SO4(p) → 2PbSO4(т) +2H2O(p) (25).
Для расчета ЭДС аккумулятора используют выражение, которое получается из уравнения Нернста
Е = 2,041 + 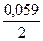 lg{[a2(SO42-) ∙ a4(H+)]/ a2(H2O)} (26),
lg{[a2(SO42-) ∙ a4(H+)]/ a2(H2O)} (26),
где a(SO42-) – активность (концентрация) ионов SO42-, а(Н+) – активность ионов водорода;
a(H2O) активность молекул воды.
Из уравнения (26) видно, что с ростом активности (концентрации) H2SO4, увеличивается ЭДС, но при концентрации кислоты более 40 %, резко уменьшается электропроводность раствора и увеличивается растворимость свинца. Оптимальными являются 32 – 39 %-ные растворы H2SO4.
Достоинством свинцовых аккумуляторов является высокий кпд, достигающий 80 %, высокая ЭДС, устойчивость в работе. К недостаткам следует отнести малый срок службы (2 – 5 лет), токсичность свинца, выделение водорода при зарядке.
Кроме кислотных используются щелочные аккумуляторы, такие как никель-кадмиевые и никель-железные. Они более долговечны, срок службы достигает 10 лет. В этих аккумуляторах в качестве электролита используют раствор гидроксида калия KOH. Уравнение электродных процессов при разряде никель-кадмиевого аккумулятора имеют вид
(-) А: Cd(т) +2OH-(p) → Cd(OH)2(т) +2е- (27)
(+) K: 2NiO(OH)(т) + 2Н2О(р) +2е- → 2Ni(OH)2(т) +2ОН-(р) (28).
Суммарный токобразующий процесс имеет вид
Cd(т) + 2NiO(OH)(т) + 2Н2О(р) → Cd(OH)2(т) + 2Ni(OH)2(т) (29).
Топливные элементы.
Топливные элементы – это устройства непрерывного действия, в которых энергия сгорания топлива непосредственно превращается в электрическую энергию. Они относятся к первичным источникам тока. Окисление топлива происходит на поверхности электродов, материалом которого является графит, либо платина, серебро, никель. В качестве топлива (восстановителя) используется водород, гидразин, уголь, оксид углерода, различные углеводороды. Окислителем в топливных элементах обычно является кислород или воздух.
Для примера рассмотрим водородно-кислородный топливный элемент с щелочным электролитом. Электролитом является 30-40 %-ный раствор КОН.
Принцип работы такого топливного элемента основан на реакции окисления водорода
Н2 +0,5О2 → Н2О (30).
При этом химическая энергия окисления водорода превращается в электрическую. Катод и анод изготовлены из угля и металла платиновой группы. Данный металл является катализатором и имеет пористую структуру. К катоду подводится кислород или воздух, который восстанавливается до гидроксид-ионов. К аноду подается водород, окисляющийся до воды. Уравнения электродных процессов имеют вид
(-) A: 2H2 + 4OH- → 4H2O + 4e- (31)
(+) K: O2 + 2H2O +4e- → 4OH- (32).
Суммарная токобразующая реакция имеет вид
2Н2 + О2 → 2Н2О (33).
Обычное значение ЭДС топливных элементов составляет 1,0 – 1,5 В.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1922; Нарушение авторских прав?; Мы поможем в написании вашей работы!