
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тяжелые металлы
|
|
|
|
Металлы в очень высокой степени вовлечены в антропогенную деятельность, они отличаются настолько высокой технофильностью, что нередко говорят о современной «металлизации» биосферы. Особое значение приобрело загрязнение биосферы группой так называемых «тяжелых металлов» (ТМ). К ним относят более 40 химических элементов периодической системы Д. И. Менделеева с атомными массами свыше 50 а.е.м. Иногда тяжелыми металлами называют элементы, которые имеют плотность более 7-8 тыс. кг/м3 (кроме благородных и редких). Оба определения условны и перечни ТМ по этим формальным признакам не совпадают. И хотя термин «тяжелые металлы» неудачен, им приходится пользоваться, так как он прочно вошел в экологическую литературу. Группа элементов, обозначаемых ТМ, активно участвует в биологических процессах, многие из них входят в состав ферментов. Набор «тяжелых металлов» во многом совпадает с перечнем «микроэлементов». Также их называют «следовые», «малые», «редкие», «рассеянные». Большинство микроэлементов выполняет в живых организмах функции инициаторов и активаторов биохимических процессов. В число микроэлементов входят и многие неметаллы.
К числу тяжелых металлов относят хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, молибден, кадмий, олово, сурьму, теллур, вольфрам, ртуть, таллий, свинец, висмут и др. Главным природным источником ТМ являются породы (магматические и осадочные) и породообразующие минералы. Многие минералы в виде высокодисперсных частиц включаются в качестве акцессорных (микропримеси) в массу горных пород. Примером таких минералов являются минералы титана (брукит, ильменит, анатас), хрома (FeCr2O4). Породообразующие минералы содержат также рассеянные элементы в качестве изоморфных примесей в структуре кристаллических решеток, замещая макроэлементы с близким ионным радиусом. Так, К может быть замещен на Sr, РЬ, В; Na - на Cd, Mn, Sr, Bi; Mg - на J, Co, Zn, Sb, Sn, РЬ, Mn; Fe - на Cd, Mn, Sr, Bi. Многие элементы поступают в биосферу с космической и метеоритной пылью, с вулканическими газами, горячими источниками, газовыми струями.
Поступление тяжелых металлов в биосферу вследствие техногенного рассеяния осуществляется разнообразными путями. Важнейшим из них является выброс при высокотемпературных процессах (черная и цветная металлургия, обжиг цементного сырья, сжигание минерального топлива). Кроме того, источником загрязнения биоценозов могут служить:
- орошение водами с повышенным содержанием тяжелых металлов;
- внесение осадков бытовых сточных вод в почвы в качестве удобрения;
- вторичное загрязнение вследствие выноса ТМ из отвалов рудников или металлургических предприятий водными или воздушными потоками;
- поступление больших количеств тяжелых металлов при постоянном внесении высоких доз органических, минеральных удобрений и пестицидов, содержащих тяжелые металлы.
Несмотря на значительное разнообразие соединений тяжелых металлов, поступающих в почву из окружающей среды, формы нахождения элементов в составе газопылевых выбросов предприятий цветной металлургии довольно однотипны - они представлены преимущественно оксидами. Количество сульфидов и водорастворимых фракций тяжелых металлов сравнительно невелико.
Первым этапом трансформации оксидов ТМ в почвах является взаимодействие их с почвенным раствором и его компонентами. Даже в такой простой системе, как вода, находящаяся в равновесии с СО2 атмосферного воздуха, оксиды тяжелых металлов подвергаются изменениям и существенно различаются по своей устойчивости. Оксид цинка наиболее стабилен и менее растворим по сравнению с оксидами свинца и кадмия. Его растворимость в диапазоне рН 4-8 более чем в 100 раз ниже, чем раствормость РЬО, и почти в 10000 раз ниже CdO. В отличие от оксида цинка оксиды свинца и кадмия неустойчивы в воде и преобразуются в гидроксид и (или) карбонат (гидроксокарбонат) свинца и карбонат кадмия.
Парциальное давление СО2 в почвенном воздухе во много раз превышает таковое в атмосфере и поэтому в почве преобладают более устойчивые гидроксокарбонаты и карбонаты цинка и свинца. Следующими реакциями после растворения неустойчивых оксидов являются катионный обмен и специфическая адсорбция. Реакции адсорбции и катионного обмена могут быть описаны уравнениями Фрейндлиха, Ленгмюра и закона действующих масс.
Ионы тяжелых металлов способны специфически адсорбироваться почвами с образованием относительно прочных связей координационного типа с некоторыми поверхностными функциональными группами.
Специфическая адсорбция более избирательна, чем неспецифическая, и зависит как от свойств сорбируемых ионов, так и от природы поверхностных функциональных групп, поэтому тяжелые металлы энергично адсорбируются почвами из растворов. Механизм специфического поглощения более свойствен свинцу, чем цинку и кадмию. Коэффициенты селективности, рассчитанные для обменной реакции катионов тяжелых металлов с поглощенным кальцием, подтверждают преимущественное поглощение тяжелых металлов по сравнению с кальцием, а в ряду тяжелых металлов селективность адсорбции свинца более чем в 1000 раз выше, чем цинка и кадмия. Таким образом, процесс трансформации поступивших в почву в процессе техногенеза тяжелых металлов включает следующие стадии:
♦ преобразование оксидов тяжелых металлов в гидроксиды (карбонаты, гидроксокарбонаты);
♦ растворение гидроксидов (карбонатов, гидроксокарбонатов) тяжелых металлов и адсорбция соответствующих катионов тяжелых металлов твердыми фазами почв;
♦ образование фосфатов тяжелых металлов и их соединений с органическими веществами почвы.
Железо. Железо относится к числу сидерофильных элементов (типичных металлов), имеющих химическое сродство к углероду (с образованием карбонатов), к фосфору (фосфаты), к сере и кремнию (сульфаты, сульфиды, силикаты). Помимо железа к сидерофильным элементам относят кобальт, никель, молибден, технеций, рутений, родий, осмий, иридий и платину. При окислительном выветривании и почвообразовании образуются и накапливаются в биосфере минералы железа (Ш), преимущественно оксиды и гидроксиды, слаборастворимые и геохимичеоки относительно инертные. В почвах обнаружены многие минералы железа (II) и железа (III), в том числе оксиды: гематит Fe2O3, магнетит FeO∙Fe2O3; гидроксиды: гетит FeOOH, лимонит 2 Fe2O3∙3H2O; сульфиды; кислые железистые минералы: ярозит [NaKFe6(OH)12(SO4)4], феронатрит [Na3Fe(SO4)3∙ЗН2О], фосфаты, силикаты, арсенаты железа, органожелезистые соединения, аморфные осадки гидроксидов. Различные соединения железа играют существенную и весьма сложную роль в почвенных процессах в связи со способностью элемента менять степень окисления с образованием соединений различной растворимости, окисленности, подвижности.
Почвенно-геохимическая судьба соединений железа обусловлена кислотно-основными, окислительно-восстановительными условиями, аэрированностью и увлажненностью почвы, микробиологической активностью. Восстановление железа (и марганца) происходит при E ниже (+300)-(+400) мВ. В автоморфных почвах, как правило, преобладают соединения железа (III) при значениях E около (+400)-(+650) мВ; в гидроморфных почвах, если E опускается до (+300)-(+400) мВ, представлены либо обе формы железа, либо железо (II).
Биогеохимический цикл соединений железа и марганца представляется следующим. Выветривание и почвообразование сопровождаются десиликацией пород и потерей оснований, окислением соединений железа и марганца, образованием осадков оксидов и гидроксидов. Во влажных субтропиках образуются кислые коры выветривания (красноземы, бокситы), обогащенные окисленными соединениями железа, марганца, а также титана и алюминия. Этот процесс осложняется растущей кислотностью среды, наличием органического вещества, деятельностью микроорганизмов. При развитии восстановительных процессов активизируется геохимическая миграция железа и марганца в виде хелатных соединений, гидрокарбонатов, сульфатов.
С водными потоками геохимически активные соединения железа, марганца интенсивно мигрируют, но при смене теплового, окислительно-восстановительного, кислотно-основного режимов, минерализации органического вещества (иными словами, при прохождении потоков через геохимические барьеры) соединения железа и марганца осаждаются и аккумулируются. Выветривание, переувлажнение, кислотно-анаэробное почвообразование способствуют постоянному пополнению подвижных соединений железа и марганца.
Аэрация восстановленных горизонтов почвы, различных отвалов, терриконов приводит к реакциям окисления; при этом присутствующие в таких материалах сульфиды железа преобразуются в сульфаты железа с одновременным образованием серной кислоты:

В таких средах значения рН могут опускаться до 2,5-3,0. Серная кислота разрушает карбонаты с образованием гипса, сульфатов магния и натрия. Периодическая смена окислительно-восстановительных условий среды приводит к декарбонизации почв, дальнейшему развитию устойчивой кислой среды с рН 4-2,5, причем соединения железа и марганца накапливаются в поверхностных горизонтах.
Гидроксиды и оксиды железа, марганца при образовании осадков легко захватывают и связывают никель, кобальт, медь, хром, ванадий, мышьяк.
Свинец. В IV группе периодической системы особое значение имеет свинец вследствие его высокой токсичности. Свинец ингибирует ферментативные реакции, вступая в химическое взаимодействие с белками и осаждая их. Присутствие повышенных концентраций свинца в воздухе и продуктах питания представляет угрозу для здоровья человека.
В характерных для биосферы условиях свинец представлен соединениями со степенями окисления +2 и +4 (оксид РbО и диоксид свинца РbО2). Более устойчивы и распространены в природе соединения Рb(II). Наибольшее влияние на состояние свинца в почвах могут оказывать анионы: СО32-, ОН-, S2-, РО43- и SO42-. Попадающий при химическом загрязнении в почву свинец сравнительно легко образует гидроксид при нейтральной или щелочной реакции. Если почва содержит растворимые фосфаты, тогда Рb(ОН)2 переходит постепенно в Рb3(РO4)3 или другие труднорастворимые фосфаты, например плюмбогуммит РbА13Н(ОН)6(РO4)2. Эти соединения преимущественно определяют уровень содержания Рb в почвенных растворах, который в нейтральной среде близок к 10-8 моль/л.
Растворимость соединений свинца в диапазоне рН 8,5-11,0 и в восстановительных условиях при рН 2 низкая - менее 1 мг/л.
В интервале рН 6-8 растворимость элемента является сложной функцией рН, концентрации СО2 и соединений серы в воде.
Мировое производство свинца постоянно возрастает, причем выбросы свинца в атмосферу достигают 4300∙103 т в год и его антропогенное поступление значительно превышает природное. При сжигании нефти и бензина в окружающую среду поступает не менее 50% всего антропогенного свинца, что является важной составляющей в глобальном цикле элемента (рис.8). Автомобильные выхлопы дают около 50% общего неорганического свинца, попадающего в организм человека. Другим важным источником антропогенного поступления свинца в окружающую среду является производство черных и цветных металлов, а также горнодобывающая промышленность. Добыча, переработка, выплавка металла сопровождается рассеиванием свинца в биосфере, причем часто в более активной
миграционно способной форме, чем его природные соединения. Большая часть элемента находится в природе в рассеянном состоянии: он входит в состав более чем 200 минералов, и только три из них образуют промышленные запасы элемента: галенит PbS, англезит PoSO4, церрусит РbСОз. Свинец входит в состав многих породообразующих минералов. Так, в калиевых полевых шпатах (ортоклаз и микроклин) содержится от 10 до 280 мг/кг свинца.

Рис. 8. Глобальный цикл свинца в окружающей среде (106 кг/год)
Хром. Хром отличается широким разнообразием состояний окисления (от +2 до +6) и способностью образовывать комплексные анионные и катионные ионы, например Сг(ОН)2+, СгО42-. В природных соединениях он имеет степени окисления +3 и +6. Высокоокисленные формы хрома менее устойчивы, чем Сг3+.
Главными источниками хрома в биосфере являются промышленные отходы (гальванические осадки, отходы кожевенных заводов и производств, где хром содержится в составе пигментов и красителей), осадки сточных вод. Другими менее важными источниками загрязнения хромом являются воды из циркуляционных систем охлаждения, производство клея, средства для стирки белья. Источниками загрязнения являются также жидкие стоки кожевенных производств, красилен, отвалы шлаков при производстве феррохрома, хромовых сталей; некоторые фосфорные удобрения содержат до 102 - 104 мг/кг хрома.
Поступающий из антропогенных источников Сг(VI) в пресных водах восстанавливается до Сг3+, а затем сорбируется взвесью и донными осадками. Поступление бытовых стоков в реки вызывает резкое падение содержания растворенного кислорода и образование сероводорода. Это в 2,5 - 3 раза снижает долю соединений Сг(VI) от общего содержания хрома в растворе.
Поведение хрома зависит как от рН, так и от окислительно-восстановительного потенциала. Так, при одном и том же значении E = 500 мВ в интервале рН 5-7 преобладает Сг (III), а при рН>7 - Сг (VI). На поведение хрома существенное влияние оказывают органические вещества. Биогеохимическис циклы хрома подробно изучены на примере экосистем пресных и соленых водоемов. Модель круговорота хрома в морской экосистеме показана на рис.9. Установлено, что соединения Сг(VI) и органические соединения хрома не соосаждаются с гидроксидом железа в морской воде; в водах хром на 10-20% представлен формой Сг3+, на 25-40% - Сг (VI), на 45-65% - органической формой.
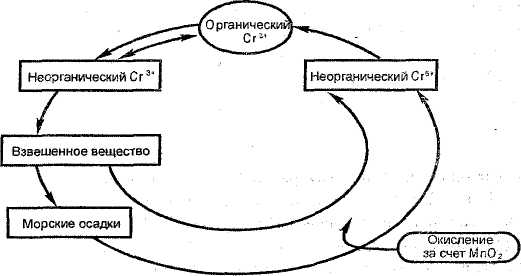
Рис.9. Круговорот хрома в морской воде
Поскольку хром (III) в кислой среде инертен (выпадая почти полностью в осадок при рН 5,5), его соединения в почве весьма стабильны. Напротив, хром (VI) крайне нестабилен и легко мобилизуется в кислых и щелочных почвах. Снижение подвижности хрома в почвах может приводить к его дефициту в растениях.
Установлено, что известкование, а также применение фосфора и органических веществ существенно снижают токсичность хроматов в загрязненных почвах. При загрязнении почв хромом (VI) подкисление, а затем применение восстанавливающих агентов (например, серы) используется для восстановления его до хрома (Ш), после чего проводится известкование для осаждения соединений Сг (III).
Стронций. Sr - хороший пример ранее малоизученного элемента, который теперь служит объектом особого внимания в связи с большой опасностью его радиоактивного изотопа для человека и животных. По свойствам стронций похож на кальций. На 1000 атомов кальция, учатвующих в биогеохимическом цикле в природе, приходится 2,4 атома стронция. При производстве ядерного оружия и при работе атомных станций среди отходов обнаруживается радиоактивный стронций-90, который был неизвестен до расщепления атома человеком. Даже ничтожно малые количества радиоактивного Sr, поступающие в окружающую среду с утечками из ядерных реакторов и после испытаний атомного оружия, опасны, поскольку мигрируют вместе с кальцием. Стронций, попадая через растения и животных в пищу человека, может накапливаться в костных тканях людей, как и кальций. По мнению некоторых ученых, в костях человека уже содержится такое количество стронция, которое может оказывать канцерогенное действие.
Ртуть. В соединениях ртуть может быть как двухзарядной, так и формально однозарядной; она характеризуется высоким потенциалом ионизации и окислительным потенциалом, является химически стойким элементом. Одной из главных особенностей иона ртути является способность к образованию комплексных соединений с координационными числами от 2 до 8. Связь «ртуть - лиганд» во всех комплексах является ковалентной. Наиболее устойчивы комплексы с лигандами, содержащими атомы галогенов, углерода, азота, фосфора, серы. Ртуть образует также значительное число комплексов с органическими реагентами, характеризующихся высокой прочностью (8-меркаптохинолин, тиомочевина). Известны и ртуть органические соединения типа RHgX или R2Hg, обнаруженные в последнее время в различных компонентах биосферы - донных осадках, природных водах.
Ртуть встречается в природе как в самородном состоянии, так и в соединениях, образуя ртутные минералы: киноварь HgS, тиманит HgSe, ливингстонит HgS∙2Sb2S3, монтроидит HgO. Ртуть входит в качестве изоморфной или механической примеси в реальгар, антимонит, молибденит, пирит, пирротин, сфалерит. Среднее содержание ртути в каменном угле составляет 1∙10-6 %.
За геологическое время в биосферу в результате природных процессов (вулканическая деятельность) поступило около 1,6∙1010 т ртути. Около 0,1% остается в океанах в растворенном виде.
Биогеохимический цикл ртути Hg - пример круговорота природного элемента, который почти не влиял на организмы до наступления индустриальной эры. Ртуть химически малоподвижна, а концентрации ее в природе невелики. Разработка месторождений и промышленное использование увеличили поток ртути в атмосферу. Соответственно увеличился и ее сток с поверхностными водами. Увеличение содержания ртути, как, впрочем, и других тяжелых металлов (кадмия, меди, цинка, хрома) в окружающей среде стало серьезной проблемой. Ртуть используется в различном электротехническом оборудовании, термометрах, зубных пломбах, лекарствах, красках, фунгицидах и др. Больше половины расходуемой ртути не возвращается в производство. Это означает, что она попадает в природные воды и оказывается в окружающей среде.
На рис.10 показаны оценки потоков ртути в сравнении с ее потоками в доиндустриальный период. Запасы ртути указаны в прямоугольниках в сотнях тонн, а потоки (стрелки) - в сотнях тонн в год. Цифры в скобках показывают потоки до появления человека. Штрихами обозначены два новых потока, порожденных деятельностью человека.
В результате разработки отложений и увеличения выбросов ртути возрастает ее количество в почвах, воде, живых организмах. При этом микроорганизмы, участвующие в круговороте, превращают ее нерастворимые формы в растворимую, очень подвижную и очень ядовитую -

Рис.10. Схема круговорота ртути
метилртуть. Рыбы и моллюски накапливают метилртуть до концентраций, опасных для человека, использующего их в пищу.
Трансформация веществ в окружающей среде и накопление их в живых организмах в процессе круговорота должны учитываться при использовании опасных химических элементов.
Заключение
Все рассмотренные выше биохимические круговороты охватывают многокилометровые толщи земной коры, но их движущей силой является деятельность живого вещества, которое, по мнению академика В.И. Вернадского, образует наиболее существенную и неотделимую часть литосферы.
Помимо вышеупомянутых основных элементов, которые принимают участие в биологическом круговороте веществ, важную роль играют также некоторые другие элементы, входящие в состав питания растений. В той или иной степени все элементы таблицы Д.И. Менделеева вовлечены в биологический круговорот.
Следует уточнить, что термин «круговорот веществ» употребляется в переносном смысле. Истинный круговорот совершают элементы: углерод, кислород, водород, азот и др. На каждом этапе круговорота они входят в состав различных соединений - простых (вода) или сложнейших (живой белок), а иногда выступают и в свободном состоянии. Поэтому более точно было бы говорить о круговороте элементов, а не о круговороте веществ.
Знание круговоротов веществ на Земле имеет большой практический интерес, так как он существенно влияет на жизнь человека, и в тоже время все значительнее проявляется воздействие человека на природные процессы. Последствия отрицательных воздействий человека на биосферу стали сравнимы с геологическими процессами. Так, в результате деятельности человека в биосфере возникли новые пути миграции вещества, прежде ей не свойственные. Появились новые химические соединения, не свойственные природе, - ксенобиотики (ксено – чужие, биота – живые). В конечном итоге на локальном и глобальном уровнях результатом деятельности человека является формирование нового, отличного от природного состава атмосферного воздуха, изменение состава природных вод и др. Это в свою очередь приводит к серьезным экологическим проблемам, масштаб которых позволяет отнести их к разряду общепланетарных. К таким проблемам можно отнести: прирост диоксида углерода в атмосферном воздухе, загрязнение атмосферы диоксидом серы, накопление в атмосфере фреонов, изменение радиационного фона, загрязнение водоемов фосфорсрдержащими веществами и многие другие.
Вопросы для самоконтроля
1. Дайте определение биогеохимическим круговоротам. Какова их роль в обеспечении жизни на Земле?
2. Чем различаются большой и малый круговороты веществ?
3. Какой процесс лежит в основе большого круговорота веществ?
4. Какие процессы лежат в основе малого круговорота веществ?
5. Что называют биогеохимическими циклами?
6. В чем различие газообразных и осадочных биогеохимических циклов?
7. Какова роль и функции живого вещества в круговороте по теории В.И.Вернадского?
8. В результате каких процессов происходит поступление углекислого газа в атмосферу в современных условиях?
9. Какие типы химических реакций лежат в основе важнейших биогеохимических круговоротов веществ?
10. Почему правильнее говорить «круговорот элементов», а не круговорот веществ»? Подтвердите конкретными примерами.
11. Какие факторы обуславливают практически постоянный состав атмосферного воздуха в течение всей истории развития человеческого общества?
12. Назовите процессы, в результате которых углекислый газ связывается.
13. Как влияет человек на содержание СО2 в атмосфере?
14. Какие ядовитые соединения углерода могут накапливаться в
воздухе, как они влияют на человека?
15. Какие процессы лежат в основе круговорота азота?
16. Какого рода процессы (физические, химические, биологические) относят к нитрификации? К денитрификации?
17. Какие организмы могут усваивать газообразный азот из атмосферы? Как называется этот процесс?
18. Почему азотные удобрения более дорогие, чем другие виды
удобрений?
19. Как влияет человек на круговорот азота?
20. В чем особенности круговорота фосфора?
21. Как влияет человек на биогеохимический цикл фосфора?
22. К каким последствиям приводит избыточный сток фосфора в
реки, озера, моря?
23. Назовите пути техногенного поступления тяжелых металлов в биосферу.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 5733; Нарушение авторских прав?; Мы поможем в написании вашей работы!