
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрический метод анализа
|
|
|
|
Электрохимические методы анализа
Вірна відповідь 2
Вірна відповідь 1
Розглянемо наступні завдання.
Задача 1. Визначити значення змінної P після виконання наступних операторів:
P:=1; j:=1; while j<6 do j:=j+1; P:=P*j;
Вірна відповідь 6
Задача 2. Визначити значення змінної P після виконання наступних операторів:
P:=1; j:=2; while j>2 do begin P:=P+j; j:=j–1 end;
Задача 3. Визначити значення змінної P після виконання наступних операторів:
P:=1; j:=6; while j>6 do j:=j–1; P:=P*j;
Вірна відповідь 6
Задача 4. Визначити значення змінної P після виконання наступних операторів:
P:=1; j:=2; repeat P:=P*j; j:=j–1 until j<=1;
Вірна відповідь 2
Задача 5. Визначити значення змінної P після виконання наступних операторів:
P:=0; K:=–2; For i:=2 to K do P:=P+i;
Вірна відповідь 0
Задача 6. Визначити значення змінної P після виконання наступних операторів:
P:=1; n:=2; For i:=2 downto n do P:=P*i;
Задача 7. Вкажіть номер рядка в якому є помилка. Поясніть свою відповідь.
{01} var k, i:integer; y:real;
{02} begin
{03} k:= 0; y:=1;
{04} for i:=–1 to cos (k) do y:=2*y; //cos(0)=1
{05} writeln(y);
{06} end.
Вірна відповідь: Помилка в рядку 04. За визначенням циклу For, у якості кінцевого значення параметру циклу не може бути використаний вираз cos (k), тому що тип його результату Extended не є порядковим
Задача 8. Вкажіть номер рядка в якому є помилка. Поясніть свою відповідь.
{01} var j, i:integer;
{02} begin
{03} j:=0;
{04} for i:=j-1 to j+4 do i:= i+1;
{05} writeln(j);
{06} end.
Вірна відповідь: Помилка в рядку 04. Забороняється змінювати параметр циклу For зсередини тіла циклу
План:
1. Потенциометрический метод анализа.
2. Вольтамперометрический метод анализа.
3. Кондуктометрический метод.
Электрохимические методы основаны на процессах, происходящих на электродах или в межэлектродном пространстве электрохимической ячейки.
При выполнении анализа используют либо функциональную зависимость тока, потенциала, электрической проводимости (сопротивления) от концентрации анализируемого раствора, либо измеряют эти параметры с целью установления конечной точки титрования определяемого вещества подходящим титрантом.
В электродах и во внешних проводниках электричество переносится электронами, они движутся от анода к катоду. В растворе электричество переносится ионами. Цепь замыкается за счет того, что ионная проводимость на поверхности электродов переходит в электронную. Измерительное устройство во внешней цепи может быть пассивное, а может быть и активное – можно контролировать и регулировать направление и глубину протекания окислительно-восстановительной реакции.
Ячейки бывают двух типов:
Гальванический элемент – это ячейка, которая работает самопроизвольно и служит источником электрической энергии, возникающей за счет протекания в ней химических реакций.
Эту же ячейку можно присоединить к внешнему источнику напряжения. В этом случае, приложив достаточное напряжение, можно изменить направление окислительно-восстановительной реакции и заставить протекать ток в противоположном направлении.
Электрохимическую ячейку, являющуюся потребителем энергии, необходимой для протекания в ней химических реакций, называют электролитической ячейкой.
Независимо от режима работы ячейки, один из электродов должен обратимо реагировать на изменение концентрации вещества (индикаторный электрод), а потенциал второго электрода должен быть устойчив, воспроизводим и не зависеть от состава раствора. Второй электрод называется электродом сравнения, это точка отсчета измеряемого параметра индикаторного электрода.
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС) электрохимической ячейки:
E = E1 – E2,
где E – электродвижущая сила; E1 и E2 – потенциалы электродов в исследуемой цепи. Электрохимическая ячейка в этом методе представляет гальванический элемент.
Измеряемый потенциал электрода Е связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:

 ,
,
где E0 – стандартный потенциал редокс-системы;
R – универсальная газовая постоянная (8,312 Дж/моль∙К);
Т – абсолютная температура, К;
F – постоянная Фарадея, равная 96500 Кл/моль;
n – число электронов, принимающих участие в электродной реакции;
aox, ared – активности соответственно окисленной и восстановленной форм редокс-системы;
[ ox ], [ red ] – их молярные концентрации;
fox, fred – коэффициенты активности.
Подставляя 25°С и числовые значения констант в уравнение Нернста, получаем:
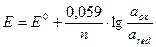
Здесь следует остановиться на характерной особенности потенциометрии: в уравнение Нернста входят активности. Это особенно важно для биохимических, медико-биологических, клинических исследований.
Ионометрия позволяет определить активность свободного, как говорят медики, «ионизированного» кальция(II).
Потенциометрические методы анализа подразделяются на:
- прямую потенциометрию (ионометрию) - основаны на прямом применении уравнения Нернста для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу соответствующего электрода
- потенциометрическое титрование - точку эквивалентности определяют по резкому изменению (скачку) потенциала вблизи точки эквивалентности.
Для проведения потенциометрического анализа обычно собирают гальванический элемент, который состоит из индикаторного электрода и электрода сравнения, которые опускают в анализируемый раствор
Индикаторным называют электрод, потенциал которого зависит от концентрации (активности) определяемого иона. Потенциал электрода сравнения должен оставаться постоянным независимо от протекания каких-либо реакций в анализируемом растворе
Электроды подсоединяют к потенциометру. Поскольку электроды имеют большое внутреннее сопротивление, (500 – 1000 мОм), то потенциометры – это сложные высокоомные вольтметры. Для измерения ЭДС применяют компенсационную схему. Большинство потенциометров рассчитаны на измерения pH, поэтому их называют pH-метр-милливольтметр.
Все электроды можно разделить на следующие группы.
I группа – электроды I-го рода (металлические) -потенциал обратимо зависит от активности собственных ионов в растворе.
Они изготавливаются из металлов Ag, Cu, Cd, Pb, образующих восстановленную форму обратимой окислительно-восстановительной полуреакции.
Например, зависимость потенциала медного электрода от активности ионов меди Cu2+ в соответствии с уравнением полуреакции Cu2+ + 2e ó Cu выражается уравнением Нернста:
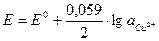
Это значит, что по измеренному потенциалу медного электрода можно судить об активности ионов Cu2+ в растворе
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!