
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вольтамперометрия
|
|
|
|
Ионоселективные электроды
| ИСЭ | Электродактивное вещество, | Определяемый ион |
| Фторид-селективный | монокристалл LaF3 | F- |
| Стеклянный | стекло H+(p-p) + Na+(cтекло) ó H+(cтекло) + Na+(p-p) | Н+, Na+ |
| Са-селективный | кальциевая соль эфира фосфорной кислоты | Са2+ |
| К-селективный | антибиотик валиномицин | К+ |
| Нитрат-селективный | тетрадециламмоний нитрат; комплекс Fe2+ с фенантролином [Fe(Phen)3]2+(NO3–)2 | NO3– |
Вольтамперометрическими называют методы анализа, основанные на регистрации и изучении зависимости тока, протекающего через электролитическую ячейку, от внешнего наложенного напряжения.
Вольтамперометрия была предложена в 1922 г. чешским учёным Я. Гейровским. За открытие и развитие этого метода Гейровскому в 1959 году была присуждена Нобелевская премия. Для регистрации вольтамперограмм нужна электролитическая ячейка, состоящая из индикаторного электрода (иногда его называют рабочим электродом) и электрода сравнения. Электродом сравнения обычно служит насыщенный каломельный электрод или слой ртути на дне электролизера (донная ртуть).
В качестве индикаторного используют ртутный капающий электрод (тогда метод принято называть полярографией, а полученные зависимости силы тока от напряжения – полярограммами) или микродисковые вращающиеся или стационарные платиновый или графитовый электроды (тогда метод называют вольтамперометрией).
Название метода (полярография) произошло от слова поляризация. Прохождение тока через раствор электролита резко отличается от прохождения тока через металлы. При прохождении тока через металл вещество не изменяется, часть тока затрачивается только на некоторое нагревание проводника. Прохождение тока через раствор связано с движением ионов. На электродах начинаются электрохимические процессы, которые приводят к изменению состава раствора или электрода. Таким образом, два одинаковых электрода становятся различными в результате прохождения тока через раствор. Эти два проводника становятся различными полюсами гальванического элемента, возникающего внутри электролита. Такое явление, препятствующее прохождению тока через раствор, называется поляризацией.
Например:
раствор H2SO4 → пропустим ток
Pt катод: 2H+ + 2e ó H2
Pt анод: H2O ó 2H+ + ½O2 + 2e
Прохождение тока вызывает изменение потенциала одного или обоих электродов, т.е. ячейка поляризуется. Есть различные виды поляризации – концентрационная, кинетическая и др.

Схема полярографической установки.
Анализируемый раствор 2 находится в электролизере 3, на дне которого имеется слой ртути 1, являющийся анодом. Часто в качестве анода используют насыщенный каломельный электрод. Катодом служит ртутный капающий электрод 4, соединенный с резервуаром ртути 5. Внешнее напряжение, подаваемое на электроды, можно плавно менять с помощью делителя напряжения 7 и измерять при этом гальванометром 6 силу тока, проходящего через раствор.
При вытекании из капилляра ртути образуются висячие капли диаметром 1 мм, периодически отрывающиеся от капилляра. При смене ртутных капель поверхность электрода постоянно обновляется. Это гарантирует чистоту поверхности и отсутствие загрязнения восстановленными ионами. Этот электрод имеет малую поверхность, которая во много раз меньше площади поверхности электрода сравнения.
Внешнее напряжение, налагаемое на полярографическую ячейку, расходуется на изменение потенциала ртутного капающего катода, потенциала анода и преодоление сопротивления раствора (омическое падение напряжения IR):
Евнеш. = Екат. – Еан. + IR
Т.е. на поляризацию индикаторного электрода расходуется только часть налагаемого напряжения. Но при условии, что площадь поверхности анода во много раз больше, чем у катода, поляризацией анода можно пренебречь. Из-за малой плотности тока его потенциал будет оставаться практически постоянным.
Если сопротивление раствора уменьшить, то слагаемым IR можно практически пренебречь. Для снижения сопротивления в анализируемый раствор вводят избыток индифферентного электролита, или просто фона. В качестве фонов используют соли щелочных и щелочноземельных металлов, растворы кислот, щелочей, а также разнообразные буферные смеси.
При этих условиях можно считать, что практически всё налагаемое на ячейку внешнее напряжение расходуется на изменение потенциала индикаторного электрода, т.е.
Евнеш. ≈ Екат.
Электроды подсоединены к полярографу. Полярограф обеспечивает на электродах возрастание потенциала от 0 до –3 В или до +3 В.
Типичная зависимость силы тока от приложенного напряжения

1 – остаточный ток; 2 – диффузионный ток
Потенциал, отвечающий току I=½Id, называется потенциал полуволны Е½. Его числовое значение показывает, насколько легко восстанавливается на электроде данное вещество. Это качественная характеристика вещества; потенциал полуволны непосредственно связан со стандартным потенциалом данной окислительно-восстановительной системы
Для количественного определения электроактивных веществ используется прямая пропорциональная зависимость между диффузионным током (или высотой волны) и концентрацией деполяризатора.
Зависимость диффузионного тока Id от концентрации иона С выражается уравнением Ильковича:
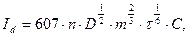
где Id – диффузионный ток; n – число электронов, принимающих участие в электродной реакции; D – коэффициент диффузии определяемого вещества; m – скорость вытекания ртути из капилляра; τ – время образования одной капли; С – концентрация деполяризатора.

Количественное определение проводят по градуировочным графикам и методом добавок
Если же в растворе есть вещества, способные восстанавливаться, то при достижении определённого потенциала ионы начнут восстанавливаться на ртутном катоде, нередко с образованием амальгамы:
Mn+ + ne + Hg = M(Hg)
При этом сила тока в цепи возрастёт (полярографическая волна). С этого момента рост потенциала электрода как бы отстает от роста налагаемого внешнего напряжения – электрод деполяризуется. Вещество, участвующее в электрохимической реакции и вызывающее деполяризацию электрода, называют деполяризатором. Если в растворе находится несколько веществ, способных к восстановлению, то по достижении определенных значений потенциала восстановления на полярограмме будет не одна волна, а несколько – по числу восстанавливающихся ионов.
Ток растёт до восстановления всех ионов, находящихся вблизи поверхности электрода. При этом ток практически не зависит от потенциала электрода. Новые порции ионов к поверхности капли из раствора доставляются за счет диффузии. Ток, соответствующий этому потенциалу, называют диффузионным током Id. Восстанавливающиеся ионы могут быть доставлены к электроду также за счет миграции и конвекции.

Если вместо интегральной полярограммы, т.е. зависимости в координатах I – E регистрировать дифференциальные полярограммы в координатах dI/dE – E, то вместо S-образных волн будут наблюдаться пики.
Это дает возможность улучшить разрешающую способность полярографического метода.
Существенное увеличение чувствительности дает инверсионная вольтамперометрия. Сущность этого метода состоит в выделении определяемого элемента из очень разбавленного раствора на ртутной капле или на графитовом электроде электролизом с последующим анодным растворением полученной амальгамы.
 Зависимость силы тока от напряжения при анодном растворении имеет вид характерного пика, глубина которого h пропорциональна концентрации определяемого иона, а потенциал минимума Emin определяется природой иона.
Зависимость силы тока от напряжения при анодном растворении имеет вид характерного пика, глубина которого h пропорциональна концентрации определяемого иона, а потенциал минимума Emin определяется природой иона.
Предел обнаружения в методике инверсионной вольтамперометрии на 2 – 3 порядка ниже предела обнаружения в обычных полярографических методиках
Кривая анодного растворения
3. Кондуктометрический анализ
В основе кондуктометрического метода анализа лежит измерение удельной электропроводности анализируемых растворов.
Электрической проводимостью W называют способность вещества проводить электрический ток, это величина, обратная электрическому сопротивлению R:  .
.
Измеряется в Ом–1 или сименсах (См).
Чтобы измерить сопротивление раствора, в него опускают электроды. Сопротивление раствора прямо пропорционально расстоянию между электродами l и обратно пропорционально площади их поверхности S:
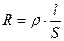 ,
,
где ρ – удельное сопротивление, Ом·См.
При l = 1 см и ρ = 1 см2 сопротивление раствора равно удельному сопротивлению R = ρ, а значит удельное сопротивление равно 1 см3 раствора.
Величина, обратная удельному сопротивлению, является удельной электропроводностью χ и представляет собой электропроводность 1 см3 раствора, находящегося между электродами с площадью поверхности 1 см2, удаленными друг от друга на расстояние 1 см.
В растворах электролитов электрический ток переносится ионами. Электрическая проводимость разбавленных растворов зависит от суммарного числа ионов в растворе (т.е. от концентрации), их зарядов и скорости перемещения в растворе под действием электрического тока. Электропроводность растворов пропорциональна их концентрации.
Прямые кондуктометрические измерения дают информацию об общей концентрации ионов в растворе. Этим методом определяют общую солевую концентрацию вод, напитков, качество молока, суммарное содержание ионов в водных вытяжках почв.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3080; Нарушение авторских прав?; Мы поможем в написании вашей работы!