
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
II группа – электроды II-го рода - потенциал обратимо зависит от активности ионов, образующих малорастворимые соединения
|
|
|
|
Эти электроды служат электродами сравнения. Они представляют собой металл, покрытый слоем нерастворимой соли. Анион у этой соли – это анион, к которому чувствителен электрод.
Например, если серебряный электрод погрузить в раствор, содержащий Cl– – ионы, то в соответствии с уравнениями
Ag+ + e ó Ag
Ag+ + Cl– ó AgCl↓
потенциал серебряного электрода будет зависеть от активности Cl– – ионов:

К электродам 2-го рода принадлежат хлорсеребряный и каломельный, используемые обычно как электроды сравнения.
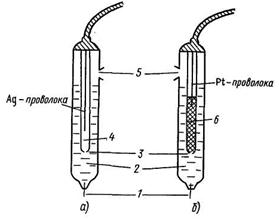
Электроды сравнения:
хлорсеребряный (а) и каломельный (б):
1 – асбестовое волокно, обеспечивающее контакт с испытуемым раствором; 2 – внешний раствор KCl (нас.); 3 – крошечное отверстие для контакта; 4 – внутренний раствор KCl (нас.), AgCl (т); 5 – отверстие для ввода раствора KCl; 6 – паста из смеси HgCl2, Hg и KCl (нас.)
III группа – инертные металлические электроды -не принимает участия в электрохимической реакции, потенциал определяется соотношением окисленной и восстановленной форм по уравнению Нернста.
Эти электроды изготавливаются из трудноокисляемых металлов – Pt, Au. Применяются они в растворах, содержащих окислительно-восстановительную пару, например, Fe3+/Fe2+, CeIV/Ce3+, MnO4–/Mn2+.
Например, потенциал платинового электрода, погруженного в раствор, содержащий ионы Fe(III) и Fe(II), в соответствии с уравнением Нернста равен

|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 893; Нарушение авторских прав?; Мы поможем в написании вашей работы!