
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В результате старения металла ударная вязкость
|
|
|
|
Как влияют на растворимость азота следующие элементы (Ni, P, C)?
Блиц – тест
Глоссарии
Парциальное давление (лат. partialis — частичный, от лат. pars — часть) — давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре. Общее давление газовой смеси является суммой парциальных давлений каждого газа в смеси.
Вакуум – это разряженная среда, в котором абсолютное давление среды намного меньше атмосферной давлений.
Концентрация — величина, характеризующая количественный состав раствора.
1.В какой последовательности усиливаются растворимость азота:
1) Ti, Al, V, Cr, Mo, S 2) Ti, V, Cr, Al, Mn, S, Mo
3) Mo, S, Mn, Al, Cr, V, Ti 4) Mo, S, V, Ti, Al, Mn
5) Mn, S, Mo, Ti, Cr, V, Al
1) указанные элементы увеличивают растворимость
2) углерод увеличивает Ni, P снижают
3) все три элемента снижают растворимость
4) никель увеличивает Р, С незначительно снижает
5) на указанные элементы добавляют Al и Cr
1) уменьшается в 4-6 раз 2) увеличивается в 4-6 раз
3) не меняется 4) увеличивается в 20-30 раз
5) уменьшается в 20-30 раз
4. Стали, имеющие высокую стойкость против коррозии в атмосфере некоторых других газовых средах речной и морской воде, растворах солей, щелочей и некоторых кислотах при комнатной и повышенных температурах называют …
1) инструментальными 2) нержавеющими
3) кипящие 4) спокойные 5) полуспокойные
5. Самым основным легирующим элементом в нержавеющих сталях является:
1) кобальт 2) вольфрам 3) хром
4) ниобий 5) кальций
6. Антикоррозионные свойства нержавеющих сталей придает:
1) кобальт 2) вольфрам 3) никель
4) ниобий 5) кальций
7. Во время продувки в электропечи окисляется и переходит в шлак большое содержание Cr2O3:
1) 20-23% 2) 30-33% 3) 40-43% 4) 50-53% 5) 60-63%
8. Содержание Cr в шихте при выплавке нержавеющих сталей в ДСП ограничивают пределами:
1) 8-9% 2) 9-1-% 3) 10-11% 4) 12-13% 5) 13-14%
9. Выплавка низкоуглеродистых нержавеющих сталей с содержанием углерода не более … в ДСП на легированной шихте до сих не осуществлена из-за высокой температуры в конце продувки (20000С) и большого угара Cr
1) 0,01% 2) 0,02% 3) 0,03% 4) 0,04% 5) 0,05%
Литература:
- Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
- Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
- Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
- Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986,
- Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
- Симбинов Р.Д., Симбинова К.Ж. Исследование вязкости жидкостей и оксидных расплавов. Актобе 2005 год
- Термодинамика и кинетика процессов диссоциации карбонатов и оксидов: лабораторный практикум. Симбинов Р.Д., Симбинова К.Ж. Актобе 2005 год.
- Симбинова К.Ж. Методические рекомендации по выполнению лабораторных работ. Алма-Ата, 1990, 75 с.
Лекция №11 «Термодинамика шлаковых систем»
План лекции:
1.Теория совершенных ионных расплавов М.И. Темкина. Теория регулярных ионных растворов. Полимерная теория шлаковых расплавов. Теория строения шлаков, как фаз с коллективной электронной системой.
2.Основы взаимодействия металлической, оксидной и газовой фаз.
3. Термодинамические основы окислительного рафинирования металлов. Кислородный потенциал оксидов. Термодинамическая устойчивость оксидов.
4. Определение активностей и коэффициентов активностей элементов.
Цель лекции:
Ознакомлением с понятиями шлаками
Дидактические единицы:
Моль; внутренняя энергия; Энтропия; Энергия Гиббса; Константа равновесия; окисление; восстановление.
1. В результате применения современных методов исследований получены подробные и надежные данные о структуре металлов и сплавов в твердом состоянии, установлены зависимости между структурой и основными физико-химическими свойствами твердых тел. О строении, физико-химических свойствах жидких металлов и шлаков известно значительно меньше, что объясняется главным образом экспериментальными трудностями, возникающими при изучении свойств жидких металлов, их сплавов и шлаков.
Основными свойствами металлических и шлаковых расплавов являются -вязкость, -поверхностное натяжение, -плотность, -электропроводность, -теплопроводность и др. Наиболее важные работы по изучению указанных свойств выполнены А.М.Самариным, С.И.Филипповым, П.П.Арсентьевым, В.И.Явойским, С.И.Попелем, А.А.Вертманом, В.Е.Еременко и др.
Металлические расплавы состоят из двух или нескольких металлов. К последним относятся элементы, обладающие большой электропроводностью, характерным блеском, пластичностью (ковкостью) и другими специфическими свойствами. Элементы, не обладающие указанными свойствами, классифицируются как неметаллы (металлоиды). В металлических расплавах они всегда содержатся в тех или иных количествах.
Вместе с тем имеются элементы, которые нельзя отнести к металлам или металлоидам. Так, сурьма обладает целым рядом свойств металлов, но ковать ее нельзя ни в горячем, ни в холодном состояниях. Критерием отнесения данного элемента к металлам или металлоидам является характер изменения его электро проводности или электросопротивления в зависимости от температуры: с понижением температуры электросопротивление металлов уменьшается, а электропроводность возрастает.
2. Характерные особенности строения атомов металлов — малое число электронов на наружных оболочках и слабая связь этих электронов с ядром. Легкий отрыв валентных электронов от ядра обусловливает появление у металлов металлических свойств: высокой тепло и электропроводности. У жидких металлов эти свойства выражены в меньшей степени, чем у твердых. Вместе с тем существуют элементы, которые обнаруживают металлические свойства только в жидком состоянии. Так, кремний и германий в кристаллической фазе — полупроводники, а в расплавленном состоянии проявляют свойства металлов. Металлоиды могут превращаться в металлы при высоких давлениях. В общей сложности более 70 элементов классифицируются как металлы, все они сохраняют свойства металлов и в расплавленном виде.
Металлы и их сплавы в твердом состоянии являются кристаллическими телами, в которых соблюдается так называемый «дальний» порядок, т. е. правильное расположение атомов или ионов в кристаллической решетке на больших расстояниях. Экспериментальные исследования структуры жидких металлов рентгеновскими и нейтронографическими методами показали, что при плавлении происходит нарушение «дальнего» порядка и уничтожение кристаллической решетки как жесткой системы центров колебаний атомов. Однако «ближний» порядок, выражающийся в стремлении каждого атома окружить себя закономерно расположенными соседями, остается. Таким образом, металлам в жидком состоянии свойственна подвижная структура, особенно отчетливая вблизи температуры плавления и размывающаяся с ее повышением.
Жидкости, как и газы, изотропны, т.е. их свойства одинаковы во всех направлениях. Для определения вязкости жидкостей А.И.Бачинский предложил формулу, согласно которой вязкость зависит от свободного объема жидкости:

где η — динамическая вязкость; V — удельный объем жидкости; С и W — константы; величина V — выражает свободный объем жидкости.
Представления А.И.Бачинского о свободном объеме жидкости находятся в соответствии с «дырочной» теорией жидкого состояния, разработанной Я.И.Френкелем. Согласно этой теории образующаяся при плавлении твердых тел жидкость испытывает местные разрывы, не приводящие к полному ее разрыву, потому что каждый атом жидкости, теряя связь с соседними, сохраняет ее с остальными атомами. Таким образом, жидкие тела можно рассматривать как имеющие множество зародышевых трещин, которые возникают в различных направлениях, а свободный (дополнительный) объем — как сумму объемов всех находящихся в них зародышевых трещин.
Экспериментальным подтверждением «дырочной» теории является тот факт, что жидкости более сжимаемы при малых давлениях, чем при больших. При плавлении металла происходит относительно небольшое увеличение объема, не превышающее 10%, и теплоемкость изменяется незначительно. Скрытая теплота плавления твердых тел и изменение энтропии имеют значительно меньшую величину, чем при испарении. В табл. 1 представлены данные об атомных теплоемкостях вблизи температур плавления некоторых металлов, о теплотах плавления, испарения и соответствующих изменениях энтропии. Они свидетельствуют о том, что при плавлении силы сцепления между частицами испытывают сравнительно небольшие изменения, а при испарении эти изменения значительны. Таким образом, по своей природе расплавленные металлы при температурах вблизи плавления значительно ближе к твердому состоянию, чем к газообразному.
Т а б л и ц а 1. -Атомные теплоемкости некоторых металлов вблизи температур их плавления, теплоты плавления и испарения и соответствующие изменения энтропии

Ценную информацию о структуре жидких металлов могут дать рентгеновские и нейтронографические методы. На рентгенограммах или нейтронограммах жидких металлов вместо резких линий, свойственных кристаллам, наблюдается изменение интенсивности отражения с изменением угла дифракции в виде ряда более или менее размытых максимумов. При перегреве жидкости максимумы постепенно размываются. Первые удачные попытки применения рентгеновских лучей к исследованию строения жидкостей были предприняты Дебаем и Шерером. Существенный вклад в развитие теории жидкого состояния внес В. И. Данилов. Он сделал ряд общих выводов о строении жидких металлов:
жидкие металлы при температурах, близких к точкам плавления, обладают структурой ближнего порядка, которая определенным образом связана со структурой в твердой фазе;
структура «ближнего» порядка атомов в жидкости определяется их тепловым движением и характером молекулярного взаимодействия;
жидкие металлы с плотной упаковкой в твердой фазе, как правило, сохраняют этот тип упаковки;
металлы с рыхлой упаковкой в твердом состоянии при плавлении обнаруживают тенденцию к переходу к более плотному типу упаковки.
При изучении структур жидких металлов учитываются специфические черты жидкого состояния, в частности изменение электронной структуры атома в жидком состоянии по сравнению с твердым. Изменение электронной структуры в конечном итоге ведет к изменению характера связи. По указанному признаку предложена классификация с разделением элементов, находящихся в жидком состоянии, на три группы — истинные металлы, полуметаллы, неметаллы.
Истинные металлы в кристаллическом состоянии имеют металлическую связь, внешние оболочки ионов достаточно прочны и не меняются при плавлении, как не меняется характер связи. Их «ближний» порядок остается постоянным, «дальний» порядок из-за ослабления связей и увеличения теплового движения исчезает.
В кристаллическом состоянии — решетки объемно-центрированные кубические или с плотной упаковкой (гранецентрированные или гексагональные). К истинным металлам, исследованным дифракционным методом, относятся щелочные металлы группы 1, переходные металлы группы VIII в (Fе, Ni) и металлы групп 1 в (Сu, Аu, Аg).
Неметаллы в кристаллическом состоянии характеризуются ковалентно-металлической или ковалентной связью. При температуре плавления или на несколько градусов выше направлениые связи нарушаются, переходя в металлическую связь, и структура «ближнего» порядка принимает черты преимущественно объемно-центрированной кубической решетки. К исследованным неметаллам относятся Sе и Те.
Полуметаллы могут быть разделены на две подгруппы:
Са, Се, Sn, Sb — при плавлении или незначителыюм перегреве расплава меняют смешанную или ковалентную связь на металлическую;
Аl, Zn, Cd, Hg, Pb — при плавлении их направленные связи переходят в металлическую связь, окончательный переход происходит при температуре значительно выше точки плавления.
В. И. Архаровым и И. А. Новохатским с сотрудниками разра-ботана квазиполикристаллическая модель расплавов. В соот-ветствии с этой моделью металлические расплавы не являются структурно-однородными фазами, а в определенном интервале температур представляют собой динамическую совокупность двух структурных составляющих. Одна из них — упорядоченная зона (кластер) - - характеризуется кристаллоподобной упаковкой.частиц, другая - разупорядоченная зона (квазигаз) — хаотическим расположением частиц.
Переходы, связанные со сменой типа упаковки атомов в кластерах, имеют место в жидком железе и других металлах и сплавах. Указанное явление, названное кластерным полиморфизмом, характеризуется скачкообразным изменением структурно-чувствительных свойств (в том числе вязкости расплава при температурах полиморфных превращений кластеров Tn-m). В интервале температур Тn-m — Траз может быть несколько полиморфных превращений.
В многокомпонентных расплавах на основе железа Тn-m могут отличаться от таковых для чистого железа. Полиморфные превращения кластеров железа в Fеж при 1640±10°С сопровождаются скачкообразным изменением структурно-чувствительных свойств жидкости (вязкости, плотности, магнитной восприимчивоети и др.). Тип упаковки в кластерах жидкого железа при T ≤ 1640 ± 10°С отвечает объемно-центрированной кубической решетке (о. ц. к.), при T ≥ 1640 ± 10°С — гранецентрированной кубической решетке (г. ц. к.).
При 1640 ± 10°С кинематическая вязкость чистого железа изменяется скачкообразно, увеличивается с 8,05-10-7 до 8,55-10-7 м2/с. Характер температурной зависимости вязкости до и после скачка является экспоненциальным, однако энергия активации вязкого течения изменяется значительно:
ν = 0,267 · 10-3е12000/RT для ≤ 1640 ± 10оС
ν = 1,322 · 10-3е7000/RT для ≥ 1640 ± 10оС
Сопоставление политерм различных структурно-чувствительных свойств (как динамических, так и статических) показывает, что в интервале температур 1600—1700°С они претерпевают разрыв со скачкообразным изменением свойств. Указанные изменения значительны, особенно для плотности, поверхностного натяжения и кинематической вязкости и не могут быть объяснены методическими погрешностями.
Для металлических и шлаковых расплавов характерна микронеоднородность. Так, повышенная вязкость чугунов, в особенности заэвтектического состава, обусловлена микронеоднородностью расплава — выделением углерода, который образует графитовую смесь.
Железоуглеродистые расплавы характеризуются микрогетерогенностью. Чугун представляет собой неравновесную и неустойчивую систему типа суспензии, состоящую из дисперсионной среды (насыщенный раствор углерода в железе) и углеродистых образований, размер которых составляет 1—10 нм (10—100 А o).
Вопрос о формах существования металлоидов, растворенных в железе, еще окончательно не решен. Имеющиеся в литературе немногочисленные данные не являются исчерпывающими и не отличаются единством точек зрения различных авторов. В металлической ванне, повидимому, кислород и сера находятся в виде анионов О2- и S2-, а углерод — в виде катиона С4+. Водород может существовать в нескольких формах: протонной Н+, атомарной Н и в виде гидридов (титана, ниобия и др.)
3. Межфазная поверхностная энергия (поверхностное натяжение), вязкость, плотность, электропроводность определяют физико-химические свойства металлических расплавов. Поверхностные явления играют важную роль в металлургии, при обогащении железных руд, в полупроводниковой технике, при защите металлов и сплавов от коррозии. Поверхностные явления происходят на границе раздела фаз. Всякая поверхность раздела по своим физико-химическим свойствам резко отличается от внутренних частиц обеих граничащих фаз. Это различие обусловливается тем, что на поверхности раздела фаз имеется избыток поверхностной энергии. Существует несколько методов измерения поверхностного натяжения. Методами максимального давления газового пузырька метод Ребиндера и лежащей капли измеряется поверхностное натяжение металлических и шлаковых фаз.
Растворение веществ в жидкостях обычно сопровождается изменением поверхностного натяжения. Так, при растворении неорганических солей в воде поверхностное натяжение на границе водный раствор — воздух незначительно повышается, а при растворении органических веществ (спирта и др.) оно значительно понижается.
Вещества, понижающие поверхностное натяжение растворов, относятея к поверхностно-активным (ПАВ). Они адсорбируются поверхностным слоем, т. е. сосредоточиваются в нем в болыпей концентрации, чем в основном объеме раствора. Вещества, повышающие поверхностное натяжение, являются инактивными.
Количественная связь между адсорбцией и изменением поверхностного натяжения выражается уравнением Гиббса:
 (1)
(1)
Б. В. Отарк и С. И. Филиппов экспериментальным путем впервые показали, что растворенные в железе кислород и углерод являются поверхностно-активными компонентами и адсорбируются на границе фаз, понижая поверхностное натяжение. При максимуме адсорбции Г∞ площадь Р, приходящаяся на одну молекулу в адсорбированном слое, составляет
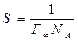 (2)
(2)
где NА — число Авогадро.
Г – адсорбция
а - активность
Толщина адсорбционного слоя  рассчитывается по уравнению
рассчитывается по уравнению
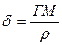 (3)
(3)
где М — молекулярная масса адсорбированного вещества; р — плотность вещества.
Большинство элементов, растворенных в железе, понижают его поверхностное натяжение. Весьма высокой поверхностной активностью обладают кислород, сера, затем бор, азот, водород.
Значительно слабее влияют на поверхностное натяжение углерод, фосфор, кремний.
Кислород, являясь высокоповерхностноактивным элементом, значительно понижает поверхностное натяжение железа. С повышением концентрации кислорода от 0,001 до 0,184% поверхностное натяжение снижается с 1865 до 1056 мДж/м2. Величина адсорбции кислорода вычислялась по уравнению Гиббса:
 (4)
(4)
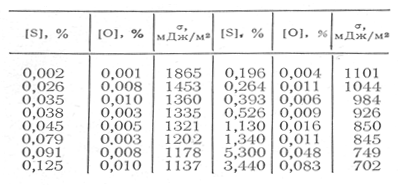
С увеличением содержания серы в жидком железе наблюдается резкое понижение поверхностного натяжения расплавов (табл. 2). В сильно разбавленных растворах влияние серы на понижение величины поверхностного натяжения железа проявляется в большей степени, - чем влияние кислорода. Температурный коэффициент поверхностного натяжения расплавов Fе — S положительный и составляет 0,34 мДж/(м2-град). При концентрации серы в железе, равной 0,03%, максимальная адсорбция серы составляет 14,60 -10-6моль/м2 [27].
На границах раздела многокомпонентных фаз в сталеплавильной ванне протекают процессы положительной и отрицательной адсорбции. Так, на границе раздела газ — металл имеет место положительная адсорбция кислорода, серы, водорода и азота.
Т а б л и ц а 2 -Поверхностное натяжение жидких расплавов Fе—S при 1550° С
При одновременном присутствии в металле указанных элементов картина усложняется в связи с неравной объемной активностью элементов и неравенством поверхностных активностей на границе раздела газ — шлак:
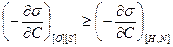
Одним из основных свойств жидкостей, в том числе расплавленных металлов и шлаков, является вязкость или текучесть. Вязкость (внутреннее трение) - свойство газов, жидкостей и твердых тел, характеризующее сопротивление их течению (для твердых тел - развитию остаточной деформации) под действием внешних сил.
§4. Существующие методы измерения вязкости разделяются на стационарные и нестационарные. К стационарным относятся методы капиллярного истечения, вращающихся цилиндров, падающего шарика и вибрационные методы. Нестационарные методы основаны на измерениях параметров системы, находящейся в контакте с исследуемой жидкостью в процессе крутильных колебаний. Метод крутильных колебаний тигля с жидким металлом, подвешенного на упругой нити, разработан Е.Г.Швидковским. Метод является достаточно совершенным и позволяет получать надежные значения вязкости расплавленных металлов и сплавов и судить об их структурных изменениях.
В качестве единицы динамической вязкости ν в системе СИ принята величина Па-с (паскаль-секунда) или Н-с/м2 (нютон•секунда/м2). В системе единица динамической вязкости характеризуется пуазом (П), имеет размерность г/(см-с), при этом ν = 0,1 Па-с. Между динамической и кинематической вязкостью существует зависимость
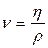 (5)
(5)
Из табл. 3, в которой представлены величины динамической вязкости различных жидкостей, следует, что вязкость стали при 1600°С в пять—девять раз болыпе вязкости воды при 25°С.
Вязкость мартеновского шлака при 1600°С выше вязкости стали при три же температуре в четыре—пять раз.
Таблица 3 - Динамическая вязкость различных жидкостей.
| № п/п | вещества | to, C | η, Па-с |
| Вода | 0,0008-0,0009 | ||
| Глицерин | 0,005 | ||
| Сталь | 0,005-0,0085 | ||
| Шлак 4.1. доменный | 0,2-0,06 | ||
| 4.2. мартеновский | 0,02-0,04 |
Экспериментальные данные о вязкости жидких металлов, перегретых выше точки плавления. Вязкость металлов при температуре плавления может определяться из следующего соотношения:
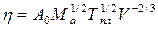 (6)
(6)
где А0 — константа; Ма и V — соответственно атомная масса металла и его атомный объем; Тпл — температура плавления, К.
Из последнего уравнения следует, что вязкость элементов зависит от М, V и Т, которые являются периодическими функциями атомных номеров элементов. Высокая температура плавления и малый атомный объем характерны для металлов с большими энергией сублимации и энергией связи между атомами. Таким образом, вязкость металлов характеризует прочность межатомной связи. Величина вязкости жидкости зависит от ее природы и уменьшается с повышением температуры. Эту зависимость для жидкости, состоящей из однородных частиц, Я.И.Френкель выражает следующим уравнением (7):
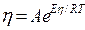
где А — постоянная, зависящая от природы жидкости; Еη — энергия активации вязкого течения.
Энергия вязкого течения характеризует собой энергию, необходимую для перехода частицы или группы частиц из одного положения равновесия в другое, и может быть определена по графически зависимости-lnη от 1/Т. В тех случаях, когда в ме-таллических и шлаковых расплавах при повышеник температуры не происходит структурных изменений или резкого ослабления связей и имеет место прямолинейная зависимость между ln η и 1/Т, величина Еη вычисляется по формуле
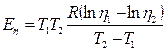 (8)
(8)
Рассмотрение сущности явления вязкого течения показывает, что величина коэффициента вязкости г) прежде всего зависит от размера частиц расплава. Наиболее крупные структурные единицы в шлаковых расплавах— кремнекислородные комплексы, структура и размер которых являются определяющими в зависимости вязкости шлака от его состава. Чем выше концентрация Sі02 в шлаке, тем большие размер кремнекислородных комплексов и тем больше вязкость шлака.
Увеличение концентрации основных окислов (СаО, МпО, FеО) способствует разрушению крупных кремнекислородных комплексов и образованию более мелких цепей из кремнекислородных анионов. При этом вязкость кислого шлака уменьшается.
K настоящему времени измерена вязкость большого количества двойных и многокомпонентных систем. Если растворы по своим термодинамическим свойствам относятся к идеальным или характеризуются положительными отклонениями от идеальности, то вязкость зависит от концентрации довольно плавно. В тех случаях, когда наблюдаются отрицательные отклонения от идеальности, на изотермах вязкости максимумы находятся обычно вблизи составов, отвечающих интерметаллическим соединениям в твердой фазе. Повышение температуры приводит к постепенному сглаживанию изотерм вязкости и к исчезновению особенностей на них. Малые концентрации растворенных примесей в большинстве случаев незначительно влияют на вязкость. Нерастворимые примеси сильно повышают вязкость жидкостей.
Вязкость жидкой стали существенно возрастает с увеличением содержания в ней корунда. С ростом температуры уменьшается относительное повышение вязкости из-за наличия в жидкой стали неметаллических включений. На основании экспериментальных данных путем линейной экстраполяции на нулевое содержание неметаллических включений была рассчитана также вязкость чистой стали.
Тип проводимости в жидких металлах не отличается от типа проводимости металлов в твердом состоянии и обусловлен наличием коллективизированных электронов. Вместе с тем переход металла из твердого в жидкое состояние сопровождается увеличением удельного сопротивления.
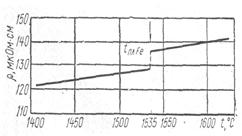
П.П.Арсентьев, С.И.Филиппов, Б.С.Лисицкий для измерений удельного электросопротивления использовали железо, полученное из электролитического порошка, переплавленного в атмосфере водорода. Величина измеренного удельного сопротивления жидкого железа при температуре плавления составила 135,1 мкОм-см. Измерения проводились после расплавления в режиме нагрева до 1600—1650°С, при охлаждении расплава вплоть до кристаллизации и затем в твердом состоянии. Политерма электросопротивления железа в твердом и жидком состояниях показана на рис. 2, из которого видно, что при плавлении железа наблюдался скачок удельного электросопротивления, оцениваемый величиной
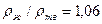 (9)
(9)
Рис. 2. Политерма электросопротивления
железа в твердом и жидком состояниях.
Уравнение температурной зависимости удельного электросопротивления жидкого железа в интервале температур от точки плавления до 1650О С имеет вид:
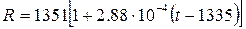
Электросопротивление твердого железа описывается следующим уравнением:
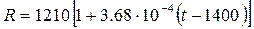
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 940; Нарушение авторских прав?; Мы поможем в написании вашей работы!