
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Блиц – тест. Энергия активации - наименьшая энергия, необходимая для осуществления элементарного акта физического или химического процесса
|
|
|
|
Глоссарии
Энергия активации - наименьшая энергия, необходимая для осуществления элементарного акта физического или химического процесса.
Внутренняя энергия – функция состояния термо – динамической системы, представляет собой сумму всех видов энергии, содержащиеся в данной системе, за исключением кинетической и потенциальной энергии системы, как единого целого.
Адсорбция -поглощающиеся вещества из газообразной или жидкой фазы поверхностным слоем твердого тела или жидкости.
Абсорбция – объемное поглощение вещества из газообразной или жидкой фазы твердым телом или жидкостью.
Мультиплет – совокупность близкорасположенных или накладывающихся друг на друга различных веществ.
Активность – параметр, характеризующий стремление вещества выделиться из раствора.
Обезуглероживание – процесс удаления углерода из жидкого или твердого металла окислением его кислородом.
| 1. Назовите уравнение зависимости вязкости от температуры в экспоненциальной форме: |
| A. ή = e B –E ή /RT B. ή = e-E ή/RT C. ή = B e-Eή /RT D. ή = e –E/RT E. ή = e-E/nГ |
| 2. Как объединяется высокая электропроводность и теплопроводность металлов? Эти свойства металлов объясняются; |
| A. Наличием свободного электронного газа; B. Структурой строение металлов; C. Высокой текучестью D. Низкой вязкостью; E. Низкой межкристаллитной связью; |
| 3. Что называется поверхностным натяжением? Поверхностным натяжением называется: |
| A. Изменение энтропии поверхности; B. Свободная энергия поверхности; C. Изменение энергии поверхности; D. Свободная энергия поверхности по изменению площади поверхности на единицу; E. Изменение энтальпии поверхности |
| 4. Что называется активностью? Активностью называется: |
| A. Способность к физическому взаимодействию; B. Эффективная концентрация разбавленных растворов; C. Эффективная концентрация совершенных растворов; D. Способность к химическому взаимодействию; E. Эффективная концентрация реальных растворов; |
| 5. Назовите условия идеальности растворов. Идеальные растворы образуются: |
| A. Без термодинамических изменений; B. Без применения состояния компонентов; C. Без изменения объема и энергетических изменении; D. Без изменения давления; E. Изменение экстенсивных факторов; |
| 6. Назовите условия идеальности растворов? |
| A. ∆G = 0, ∆S=0, B. ∆U = 0, Р = const C. ∆U = 0, ∆S = 0, ∆G = 0 D. ∆U = 0, ∆Н=0 E. ∆U = 0, ∆T=0 |
Литература:
- Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
- Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
- Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
- Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
- Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
- Симбинов Р.Д., Симбинова К.Ж. Исследование вязкости жидкостей и оксидных расплавов. Актобе 2005 год
- Термодинамика и кинетика процессов диссоциации карбонатов и оксидов: лабораторный практикум. Симбинов Р.Д., Симбинова К.Ж. Актобе 2005 год.
- Симбинова К.Ж. Методические рекомендации по выполнению лабораторных работ. Алма-Ата, 1990, 75 с.
Лекции №14 «Кинетические закономерности реакции обезуглероживания»
План лекции:
1.Закономерности нестационарных процессов (адсорбционных, химических и диффузионных) при окислительном рафинировании металлов в перемешивающихся слоях.
Цель лекции:
Ознакомление с кинетическими закономерностями реакции обезуглероживания
Дидактические единицы:
Конвертерный газ; молекулярная диффузия; турбулентная диффузия; константа равновесия; раскисление; энтропия; адиабатный процесс; энергия активации; внутренняя энергия; активатор;
абсорбция; мультиплет; активность; обезуглероживание; основность; шлак.
1. Все металлы и сплавы обладают способностью растворять газы. Обычно под газами, растворенными в железоуглеродистых расплавах, подразумеваются водород и азот. Эти газы оказывают отрицательное влияние на свойства различных марок углеродистой и легированной стали и вызывают такие дефекты металла, как флокены, шиферный излом и др. При охлаждении стали до температуры начала кристаллизации, в процессе кристаллизации, при дальнейшем охлаждении указанные газы выделяются из металла и создают существенные пороки в полуфабрикатах или готовых изделиях. Кислород не относится к газам, так как лишь незначительное его количество находится в металле в растворенном виде, основная же часть имеет форму оксидных включений.
Под растворимостью понимается количество (объемное или весовое) газа в единице массы металла (обычно 100 г) при определенном давлении газов (101,3 кПа). Растворимость газов в твердых и жидких металлах и сплавах зависит от температуры и давления этих газов. Зависимость растворимости водорода и азота в чистом железе от температуры при давлении газов 101,3 кПа показывает, что при достижении температур структурных превращений растворимость водорода и азота в железе скачкообразно изменяется. Это обусловлено тем, что в объемно-центрированной решетке 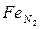 и
и 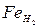 растворимость водорода и азота меньше, чем в гранецентрированной решетке Fет. Растворимость азота в Fе, с повышением температуры уменьшается, а в
растворимость водорода и азота меньше, чем в гранецентрированной решетке Fет. Растворимость азота в Fе, с повышением температуры уменьшается, а в 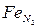 и
и 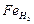 — возрастает. Растворимость водорода во всех модификациях железа с повышением температуры увеличивается.
— возрастает. Растворимость водорода во всех модификациях железа с повышением температуры увеличивается.
Двухатомные газы (водород, азот) перед растворением в жидком железе диссоциируют на атомы или ионы: Н2 —2Н; М2 = 2М. Растворимость газов при постоянной температуре пропорциональна корню квадратному из парциального давления газов (закон Сивертса):
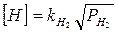 (1)
(1)
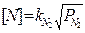 (2)
(2)
Растворимость водорода в железе при 1600°С и Рн2 = 101,3 кПа составляет 27,5 см3/100 г металла или (27,5-2,01594)/22400 = 0,00248%, где 2,01594 — молекулярная масса водорода; 22400 — объем моля газа при нормальных условиях.
Зависимость растворимости водорода и азота в металле от температуры выражается следующими формулами:
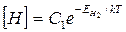 (3)
(3)
 (4)
(4)
где С1 и С2 — постоянные величины; 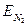 и
и  — теплоты растворения водорода и азота в металле; k — постоянная Больцмана; Т — абсолютная температура.
— теплоты растворения водорода и азота в металле; k — постоянная Больцмана; Т — абсолютная температура.
Если одновременно изменяются давление и температура газов (водорода и азота), то их растворимость в железе может быть рассчитана по следующим формулам:
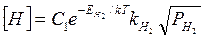 (5)
(5)
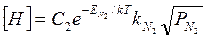 (6)
(6)
Легирующие элементы по разному влияют на растворимость водорода и азота в сплавах. Из анализа растворимости водорода в сплавах железа при 1600°С, следует, что существуют три группы легирующих элементов, по разному влияющих на растворимость водорода в железе:
- Образующие с железом относительно прочные химические соединения (углерод, кремний, бор, кислород, сера, фосфор). Уменьшают активность железа (понижают так называемую «свободную» концентрацию железа в сплаве), в результате чего снижается растворимость водорода в сплавах;
- Дающие в твердом состоянии растворы замещения, а в жидком — растворы, близкие к идеальным (молибден, никель, кобальт, марганец, хром, вольфрам). Мало влияют на растворимость водорода в сплавах;
- Образующие с водородом при невысоких температурах порядка 1000°С прочные соединения (гидриды титана, циркония, ниобия и др.), а в жидком железе — группировки атомов с водородом.
Расчетные определения коэффициентов активности водорода в углеродистых и легированных сталях выполняются с помощью параметров взаимодействия.
Растворимость водорода в углеродистой стали указанного состава примерно на 10% меньше, чем в чистом железе. Это вытекает из соотношения
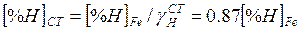
Нержавеющая сталь к концу вакуумирования имела такой химический состав: 0,02% С; 17,5% Сг; 8,0% N; 0,015% О; 0,02% S и 0,02% Р.
Растворимость водорода в нержавеющей стали на 10% выше, чем в чистом железе.
Проводимость изучения растворимости азота в бинарных расплавах железа при 1600°С. Все обычно встречающиеся в^ сплавах железа компоненты по их влиянию на растворимость азота разделяются на три группы:
- Не образующие химических соединений ни с азотом, ни с железом (молибден, никель, кобальт, медь). Мало влияют на растворимость азота в железе;
- Не образующие с азотом устойчивых при повышенных температурах соединений, но обладающие высоким химическим сродством к железу (углерод, кремний, фосфор, сера). Понижают растворимость азота в их бинарных сплавах с железом;
- Образующие прочные нитриды (ванадий, хром, ниобий, алюминий). Повышают растворимость азота в жидких сплавах железа.
Из табл. 1, в которой приведены данные о содержании водорода и азота в жидкой стали, выплавленной в различных сталеплавильных агрегатах, видно, что минимальное содержание растворенных в жидкой стали водорода и азота соответствует кислой мартеновской стали и стали, выплавленной в основных конвертерах с верхней продувкой кислородом.
Таблица 1. Содержание водорода и азота в жидкой стали
| Технологический процесс и типы стали | Содержание водорода в стали, % 104 | Содержание азота в стали, % 103 |
| Основной мартеновский: Кипящая Спокойная углеродистая Низколегироанная | 3-5 4-6 6-8 | 4-6 4-6 4-6 |
| Кислый мартеновский: Спокойная углеродистая Низколегироанная | 3-5 1-6 | 4-5 5-6 |
| Основной электропроцесс: Высоколегированная Низколегироанная | 8-11 4-7 | 15-20 7-11 |
| Основной конвертерный: С нижней продувкой воздухом С верхней продувкой кислородом Роторный | 4-6 3-5 3-5 | 10-17 2-4 3-5 |
Максимальное содержание водорода и азота содержится в высоколегированной стали, выплавленной в основных электропечах. На растворимость азота в стали оказывают влияние углерод, кремний и марганец. Первые два элемента понижают растворимость азота, марганец — повышает.
Молекулы двухатомных газов водорода и азота при контакте с поверхностью твердого или расплавленного железа (и его сплавов) под влиянием мощных сил, развиваемых поверхностным слоем атомов железа, диссоциируют на атомы. В раствор жидкого металла переходят уже не молекулы, а атомы водорода и азота. Процесс растворения молекулярного водорода характеризуется следующим изменением термодинамических функций состояния системы:
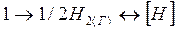
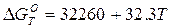 кДж
кДж
Процессу диссоциации молекул водорода на атомы отвечает такое изменение термодинамических функций:
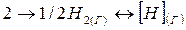
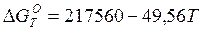 кДж
кДж
Для процесса растворимости атомарного водорода в жидком металле Н(Г) = [Н] получаем ΔGТ= -183620+81,90 Т кДж.
Особое значение имеет изменение растворимости водорода в железе при понижении его температуры в области жидкого состояния, кристаллизации и дальнейшем охлаждении. Растворимость водорода в железе при 20°С и атмосферном давлении ничтожна и составляет 7-10~-8%. Фактическое содержание водорода в сталях значительно больше — около
3-10~-3%. Из этого следует, что значительная часть водорода находится в твердом железе или сталях не в форме раствора внедрения (в виде атомов или протонов [Н+]), а в молекулярной форме — в микротрещинах и микро пустотах и создает значительные напряжения. Последние, суммируясь со структурными или термическими напряжениями, могут приводить к возникновению флокенов.
В сталеплавильных шлаках водород находится, по видимому, в виде гидроксида (ОН), который образуется по реакции
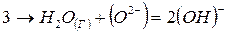
Между концентрацией водорода в шлаке и парциальным давлением водяных паров в равновесной с ним газовой фазе существует квадратичная зависимость:

Растворимость водорода в шлаке увеличивается с повышением активности ионов кислорода 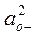 , возрастающей с повышением концентрации в шлаке и его основности. Растворимость водорода в основных шлаках небольшая и составляетл;0,0007—0,0015%. Кислые шлаки удерживают еще меньшее количество водорода. Вместе с тем и при такой растворимости имеет место интенсивный переход водорода из шлака в металл
, возрастающей с повышением концентрации в шлаке и его основности. Растворимость водорода в основных шлаках небольшая и составляетл;0,0007—0,0015%. Кислые шлаки удерживают еще меньшее количество водорода. Вместе с тем и при такой растворимости имеет место интенсивный переход водорода из шлака в металл
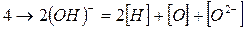
Кинетика перехода газов из газообразной фазы в расплавленный металл является сложным процессом и характеризуется следующими стадиями:
- массопереносом газа из объема газовой фазы к поверхности металла;
- адсорбцией газовых молекул на поверхности жидкого металла с разрывом связей внутри молекул газов и образованием их атомов под влиянием сил поверхностного натяжения металла;
- переходом атомов газа через границу фаз газ — металл и накоплением их в тонком слое металла;
- диффузией атомов газа в тонком не перемешиваемом слое жидкого металла;
- массопереносом атомов газа (водорода, азота) в объеме расплавленного металла.
Суммарная константа скорости перехода газа в расплавленный металл описывается следующим уравнением:
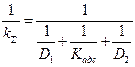 (7)
(7)
где kΣ -% — суммарная константа перехода газа в расплавленный металл; D1 и D2 — коэффициенты диффузии газов в газовой и металлической фазах соответственно.
Скорость растворения азота в чистом.железе определяется из уравнения
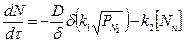 (8)
(8)
где dN/dτ— скорость растворения или удаления азота; D — коэффициент диффузии азота в пограничном слое; δ — толщина диффузионного пограничного слоя; S - поверхность реагирования; k1 - константа скорости реакции растворения азота; k2 - константа скорости реакции удаления азота;  - парциальное давление азота в месте контакта фаз; [N]n— содержание азота в металле на поверхности контакта.
- парциальное давление азота в месте контакта фаз; [N]n— содержание азота в металле на поверхности контакта.
Значительное влияние на скорость поглощения и выделения азота из металла оказывают кислород и сера, растворенные в нем. Вместе с тем на растворимость азота эти элементы практически не влияют. Следовательно, в зоне продувки металла при наличии значительного окислительного потенциала струи поглощение азота должно быть затруднено.
Кислород и сера являются поверхностно-активными элементами, понижают поверхностное натяжение металла и скапливаются на его поверхности. Расчеты показывают, что кислород и сера могут занимать практически все свободные места поверхностного слоя металла, что препятствует адсорбции азота. Кроме того, при скоплении этих элементов на поверхности происходит увеличение вязкости расплава, что приводит к понижению значений коэффициента диффузии, увеличению толщины диффузионного слоя и снижению скорости адсорбции азота.
На конечную концентрацию в стали водорода и азота, помимо состава атмосферы сталеплавильного агрегата, влияют содержание этих газов в шихтовых материалах, температурный и шлаковый режимы, скорость окисления углерода. Внепечное вакуумирование применяется для понижения концентрации водорода и азота, раскисления стали углеродом, уменьшения количества неметаллических включений и получает все большее развитие. Из всех многообразных методов вакуумирования можно выделить вакуумирование в ковше, вакуумирование струи при переливе из ковша в ковш, вакуумирование в изложнице при отливке слитков, парциальное и циркуляционное вакуумирование.
Проблема борьбы с водородом остается одной из самых актуальных и трудно решаемых. Вредное влияние водорода на сталь усугубляется значительной неравномерностью его распределения в литом металле. Отрицательная роль водорода, находящегося в металлической матрице, проявляется не только в ухудшении механических свойств стали, но и в микроне равномерности его распределения в металле. Экспериментально выявлены очень высокие концентрации водорода вблизи неметаллических включений, вторичных фаз, у микро- и макропор, вызванных выделением водорода при переходе стали через интервал кристаллизации. Большие концентрации водорода обнаруживаются в центре слитка и меньшие— в поверхностных слоях.
В различных марках углеродистой и легированной стали, выплавляемых в мартеновских печах и кислородных конвертерах, содержание водорода находится в пределах 4—8 см3/100 г металла. Для предотвращения возникновения флокенов концентрация водорода в металле не должна превышать 2 см3/100 г металла. Низкие концентрации водорода могут быть обеспечены лишь при вакуумных плавках и внепечном вакуумировании, в особенности струйном, циркуляционном и порционном.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 583; Нарушение авторских прав?; Мы поможем в написании вашей работы!