
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Блиц – тест. Конвертерный газ – это природный газ после разложения и окисления углерода до СО, т.е
|
|
|
|
Глоссарии
Конвертерный газ – это природный газ после разложения и окисления углерода до СО, т.е. в основном состоит из СО и Н2.
Молекулярная диффузия - диффузия обусловленная тепловым движением молекул.
Турбулентная диффузия - это конвективная диффузия при турбулентном движении жидкости и газа.
Константа равновесия – это параметры характеризующие вероятность протекания реакции в ту или иную сторону при данных величинах температуры и давления.
Раскисление – это удаление в металле растворенного кислорода.
Энтропия – функция состояния термо - динамической системы, при независимых параметрах, она остается постоянной при обратимым и возрастат при не обратимым адиабатном процессах.
Адиабатный процесс - процесс, при котором замкнутая система не обменивается теплотой с окружающей средой.
Энергия активации - наименьшая энергия, необходимая для осуществления элементарного акта физического или химического процесса.
Внутренняя энергия – функция состояния термо – динамической системы, представляет собой сумму всех видов энергии, содержащиеся в данной системе, за исключением кинетической и потенциальной энергии системы, как единого целого.
Адсорбция -поглощающиеся вещества из газообразной или жидкой фазы поверхностным слоем твердого тела или жидкости.
Абсорбция – объемное поглощение вещества из газообразной или жидкой фазы твердым телом или жидкостью.
Мультиплет – совокупность близкорасположенных или накладывающихся друг на друга различных веществ.
Активность – параметр, характеризующий стремление вещества выделиться из раствора.
Основность - способность вещества проявлять основные свойства, то есть в простейшем случае реагировать с кислотами.
Шлак (нем. Schlacke) - расплав (после затвердевания — стекловидная масса) в металлургических, плавильных процессах, покрывающий поверхность жидкого металла, состоит из всплывших продуктов пустой породы с флюсами.
| 1. Как читается закон Рауля? Давление насыщенного пара компонентов раствора: |
| A. Пропорционально мольной доле этого компонента; B. Обратно пропорционально мольной доле компонентов; C. Пропорционально молярности раствора; D. Пропорционально молельности раствора; E. Пропорционально нормальности раствора; |
| 2. Назовите уравнение Закона Рауля для идеальных растворов. |
| A. Pi = Pобщ/ Ni B. Pi = Pi mi C. Pi = Pобщ ni D. Pi = Pоi Ni E. Pi = Pобщ/ Ni |
| 3. Назовите уравнение Закона Рауля расплава металла. |
| A. P1 = Pобщ a1 B. P1 = P10/a1 C. P1 = P10 a1 D. P1 = Pобщ / a1 E. P1=Pобщ a2 |
| 4. Как читается ЗаконГенри-Закон растворяемости. Давление пара растворенного вещества под раствором: |
| A. Прямо пропорционально его концентрации; B. Обратно пропорционально его концентрации; C. Пропорционально концентрации растворителя; D. Обратно пропорционально концентрации растворителя; E. Пропорционально концентрации компонентов раствора |
| 5. Назовите уравнение Закона Генри для металлических расплавов. |
A. P2 = г √ a2
B. P2 = г׀ /a2
C. P2 = г׀a2
D. P2 = г׀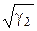 E. P2 = г׀/√a2
E. P2 = г׀/√a2
|
Литература:
- Теория металлургических процессов: учебник для вузов. Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. - М.: Металлургия, 1989, 392 с.
- Теория металлургических процессов: учебное пособие для вузов. Попель С.И., Сотников А.И., Бороненков В.И. М.: Металлургия, 1986. с.483
- Теория металлургических процессов. С.И. Филиппов.
М: Металлургия, 1967 – 279 с
Борнацский И.И. Теория металлургических процессов, учебное пособие. Киев, Донецк Высш.шк. 1978, 288 с.
- Казачков Е.А. Расчеты по теории металлургических процессов, Ю М., «Металлургия», 1986, 288 с.
- Симбинова К.Ж., Байсанов С.О., Никитин Г.Н. Физико-химия металлургических систем и процессов. Алматы 1993 г.
- Симбинов Р.Д., Симбинова К.Ж. Исследование вязкости жидкостей и оксидных расплавов. Актобе 2005 год
- Термодинамика и кинетика процессов диссоциации карбонатов и оксидов: лабораторный практикум. Симбинов Р.Д., Симбинова К.Ж. Актобе 2005 год.
- Симбинова К.Ж. Методические рекомендации по выполнению лабораторных работ. Алма-Ата, 1990, 75 с.
Лекция №15 «Укрепление и скорость разделения фаз»
План лекции:
1.Процессы ликвационного рафинирования.
2.Процессы кристаллизационной отчистки металлов и полупроводниковых материалов. 3.Равновесный и эффективный коэффициенты распределения между твердой и жидкой фазами.
4. Распределение примесей по длине слитка при нормальной направленной кристаллизации и вытягивании из расплава.
5.Распределение примесей по длине.
Цель лекции:
Ознакомление с основными разделения фаз в металлургии
Дидактические единицы:
Распределение; кислород; оксид; активность; раскисление; Энергия Гиббса; константа равновесия; раскислитель; параметр взаимодействие.
1. По ходу сталеплавильных процессов в металлической ванне уменьшается концентрация углерода, повышается температура металла и возрастает концентрация растворенного кислорода. Последний оказывает крайне неблагоприятное влияние на физико-механические и служебные свойства стали. Поэтому заключительным этапом сталеплавильных процессов является раскисление стали.
При раскислении в сталь вводятся различные элементы-раскислители, которые вступают в химическое взаимодействие с растворенным в ней кислородом. В результате образуются окислы этих элементов и другие соединения, часть их всплывает, а часть остается в закристаллизовавшемся слитке.
Наиболее распространенным методом раскисления является глубинное или осаждающее раскисление, состоящее в том, что основная часть растворенного в металле кислорода переходит в нерастворимые окислы элементов-раскислителей, вводимых непосредственно в сталь. Плотность образующихся окислов меньше плотности жидкой стали, вследствие чего они не оседают, а всплыввают вверх, что приводит к их частичному удалению из металла в шлак.
Диффузионное раскисление происходит в результате диффузионных процессов между металлом и шлаком, содержащим менее 1 % FеО. Такой шлак является восстановителем по отношению к металлу и понижает в нем содержание кислорода.
При раскислении стали в условиях вакуума резко повышается раскислительная способность углерода, и понижается равновесное с ним содержание кислорода. Продукт раскисления — газообразная окись углерода — полностью удаляется из сферы взаимодействия.
Качество стали, ее физико-механические и эксплуатационные свойства зависят от содержания в ней неметаллических включений, растворенных газов и вредных примесей. Чем меньше в стали неметаллических включений и незначительней их размеры, тем выше качество стали и изделий из нее. Основные задачи раскисления стали:
- понижение содержания (активности) растворенного в металле кислорода до определенных пределов;
- очищение металла от продуктов раскисления (оксидных неметаллических включений).
Раскисление стали — сложный физико-химический процесс, который состоит из следующих этапов:
- растворения раскислителя,
- распределения его в объеме металла,
- взаимодействия раскислителя с кислородом,
- зарождения частиц продуктов реакции раскисления,
- их всплывания,
- взаимодействия продуктов реакции раскисления со средой в процессе кристаллизации. Процесс раскисления стали в общем случае описывается реакцией
1→ m[Me]+n[O]↔(MemOn)
где Ме - элемент-раскислитель. Kонстанта равновесия реакции 1 определяется из уравнения
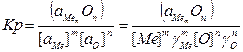 (1)
(1)
где а ме и а O — активности элемента-раскислителя и кислорода; а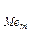 O п — активность окисла продукта раскислителя.
O п — активность окисла продукта раскислителя.
При выборе элементов-раскислителей стали необходимо руководствоваться следующим:
- 1. Элементы-раскислители должны обладать большим сродством к кислороду, чем желеао. Чем выше сродство элемента-раскислителя к кислороду, тем сильнее раскислитель, т.е. тем в большей степени уменьшается содержание остающегося в стали кислорода.
- 2. Предпочтительнее использовать элементы-раскислители, дающие окислы с более низкой температурой плавления. Это облегчает получение жидких продуктов раскисления, которые быстрее укрупняются и легче удаляются из металла.
- 3. Для ускорения всплывания продуктов раскисления окислы элементов-раскислителей и продукты взаимодействия между ними должны иметь возможно меньшую плотность.
- 4. Образующиеся окислы элементов-раскислителей должны обладать минимальной растворимостью в металле.
При исследовании раскислительной способности элементов в железе при 1600°С, установлено, что концентрация равновесного кислорода с увеличением концентрации раскислителей не во всех случаях подчиняется прямолинейной зависимости: в отдельных расплавах концентрация равновесного кислорода с повышением содержания элемента-раскислителя снижается, достигает определенного минимума, а затем снова возрастает.
Изменения раскислительной способности элементов в зависимости от их концентрации обусловлены образованием различных окислов раскислителя и их соединением с FеО. Состав продуктов раскисления железа ванадием непрерывно изменяется с увеличением его содержания в металле. В общем виде этот состав с повышением остаточного содержания ванадия в расплаве изменяется в следующей последовательности:
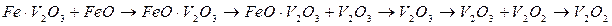 Изменение состава продуктов раскисления железа титаном (при увеличении содержания остаточного титана) изображается схемой
Изменение состава продуктов раскисления железа титаном (при увеличении содержания остаточного титана) изображается схемой
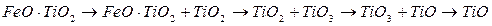
Таблица 1.
Некоторые физические свойства продуктов раскисления стали
| Состав включений | Температура плавления, оС | Плотность включений при 20оС, кг/м3 | Удельная межфазная энергия на границе с жидким металлом, мДж/м2 |
| Закись железа FeO Закись марганца MnO Кремнезем SiO2 (кварцевое стекло) Глинозем Al2O3 (корунд) Окись хрома Cr2O3 Окись титана TiO2 Окись циркония ZrO2 Силикаты железа Силикаты марганца Силикаты глинозема | 1180-1380 1380-1700 1210-1600 | 2200-2600 4000-5800 2300-4000 4000-5000 | - - - - - - - |
В табл. 1 представлены данные о некоторых физических свойствах продуктов раскисления стали. Образующиеся окислы продуктов раскисления (МnО, SіО2, АІ2О3, Сг2О3, ТiО2, Zr02) имеют температуру плавления выше 1600°С, т. е. выделяются из стали в твердом состоянии. Применение комплексных раскислителей, таких как силико-марганец, позволяет получать продукты раскисления (силикаты марганца), характеризуемые температурой плавления ниже температуры жидкой стали. Они выделяются из металла в жидком состоянии, легче укрупняются и быстрее всплывают.
Достаточно высоким сродством к кислороду обладают также редкоземельные элементы (церий, лантан, неодим, празеодим). Их окислы имеют высокую температуру плавления, служат центрами кристаллизации, не располагаются по границам зерен. Все это способствует улучшению прочности характеристик стали. При температурах сталеплавильных процессов давление паров растворенных в железе редкоземельных элементов (концентрация 1%) составляет:
| Элементы | Сe | La | Pr | Nd | Fe |
| P, Па | 1,42 | 0,13 | 0,41 | 61,6 | 5,52 |
— Из приведенных данных следует, что Се, La и Рг не должны испаряться из железа при температурах сталеплавильных процессов. Термодинамические расчеты показывают, что редкоземельные элементы являются более сильными раскислителями, чем Ті, А1,, Zr. Они не только достаточно глубоко раскисляют металл, но и восстанавливают такие продукты раскисления, как SiO2, А12О3, ZrО2. Раскислительная способность редкоземельных элементов возрастает в следующем порядке: Се, Lа, Рг, Na. Если продуктами раcкисления являются Се2О3, а не СеО3, то в порядке возрастания раскислительной способности редкоземельные элементы могут быть расположены так: Lа, Рг, Na, Се.
§2. Для определения числа зародышей, образующихся при раскислении сталей, можно пользоваться уравнением теории зарождения новых фаз:
Z= Ae-ΔG/RT (2)
где
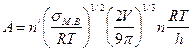
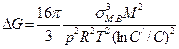
Z— число зародышей, возникающих в единицу времени в 1 см3 металла; п/ — число частиц на поверхности зародыша критического размера; V — объем, приходящийся на один атом исходной фазы; п — число атомов в единице объема исходной фазы; X и h — постоянные Больцмана и Планка; М -молекулярная масса вещества; р — плотность вещества; σм.в— межфазное натяжение на границе металл — включение; R — газовая постоянная; ΔG — изменение термодинамического потенциала при образовании зародыша новой фазы.
Критический радиус зародыша, способного к дальнейшему росту, определяется из уравнения Гиббса — Томсона:
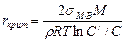 (3)
(3)
где С'/С — степень пересыщения раствора.
По уравнениям (1) и (2) рассчитаны интенсивность (I) образования зародышей и критический радиус неметаллических включений различного состава, образующихся в стали при 1600°С и степенях пересыщения 1,5; 3,5; 10. Для неметаллических включений, состоящих из FеО и МnО (при а м.в=180 мДж/м2 и С'/С=1,5), rкрит — 1,6• 10~9 м и I —1028. При этом интенсивность образования зародышей настолько большая (порядок 1028), что такое их
количество не может разместиться в 1 см3 металла. Это означает, что FеО и МnО могут самопроизвольно выделяться из металла при значительно меньших пересыщениях. В процессе охлаждения недостаточно раскисленной стали не исключена возможность образования в ней мельчайших частиц FеО и МnО. Разность плотностей этих включений и металла Δ р =1 кг/м3, поэтому они медленно всплывают.
Если составляющей оксидной фазы неметаллических включений является система FеО—МnО—SiO2, то при содержании SіО2 = 25% межфазное натяжение возрастает до 500 мДж/м2, критические размеры включений существенно увеличиваются, а интенсивность их образования I значительно снижается. Включения системы FеО— МnО—SіО2 для которых σм.в=700 мДж/м2, выделяются лишь при десятикратном пересыщении. Включения системы SіО2—А12О3—СаО, для которых ам.в=1000 мДж/м2, не могут зарождаться даже при десятикратном пересыщении.
Зарождение неметаллических включений в объеме металла затрудняется с повышением значений межфазной поверхностной энергии на границе металл—включение. Поэтому образование твердых включений окислов при раскислении сильными раскислителями (А1, Ті, Zr) может происходить лишь в результате значительного пересыщения.
По времени образования различают первичные, вторичные и третичные неметаллические включения. Первичные включения образуются сразу после ввода раскислителей в печь или в ковш, вторичные — в процессе охлаждения раскисляемого металла до температуры ликвидуса и третичные — в ходе охлаждения в двухфазной области (между линиями ликвидуса и солидуса).
В связи с трудностью проведения экспериментов влияние расхода раскислителей на образование первичных, вторичных и третичных неметаллических включений оценивали путем термодинамических расчетов для содержаний углерода в металле 0,10; 0,30; 0,5%. Активность кислорода перед раскислением ао для каждого значения концентраций [С] принимали по данным проведенных измерений э. д. с.
Сущность термодинамических расчетов состояла в следующем. По уравнениям:
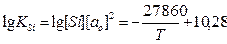 (4)
(4)
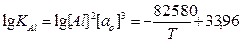 (5)
(5)
рассчитывалась активность кислорода в металле после его раскисления.
Количество первичных, вторичных и третичных включений (соответственно индексы I, II, III вверху) І-SіО2 и А12О3 определялось по разностям активностей кислорода:
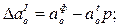
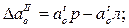
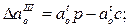
где индексами «р», «л» и «с» обозначена равновесная с данным количеством раскислителя активность кислорода в металле при температуре соответственно раскисления, ликвидуса и солидуса.
На опытных плавках железа Армко (в печи сопротивления с графитовым нагревателем) активность кислорода резко снижается в течение первой минуты после присадки раскислителей (Sі, А1).
Таблица 2. Последовательность ввода раскислителей и варианты
раскисления опытных плавок
| Вариант раскисления | Последовательность ввода раскислителя | Расход раскислителей, кг/т | |
| Al | Ti | ||
| А Б Г1 Г2 Д1 Е1 Е2 | Al+(KМБаК+FeMn) Al+(KМБаК+FeMn)+Ti (SiMn+FeSi)+Al (SiMn+FeSi)+Al+Ti Al+(SiMn+FeSi)+Ti KМБаКT Al+ KМБаКT | от 0,25 до 0,70 0,45 0,45 1,00 1,35 0,45 0,10 | 0,30 0,15-0,30 0,30 0,30 |
Это свидетельствует о быстром завершении химического взаимодействия раскислителей и растворенного в металле кислорода. Однако образовавшиеся окисные включения удаляются сравнительно медленно.
На основании термодинамических расчетов сделано заключение, что образование вторичных и третичных неметаллических включений можно в значительной степени предотвратить, увеличив содержание элементов-раскислителей в стали (в пределах, допускаемых стандартами) и обеспечив защиту струи металла от вторичного окисления при разливке. Показано также, что порядок введения раскислителей в печь не сказывается на глубине раскисления стали и слабо влияет на удаление из металла оксидных включений — продуктов раскисления. Остаточное содержание кислорода в металле, раскисленном в печи и в ковше и только в ковше, примерно одинаково.
Результаты применения комплексного сплава КМБаК (с барием) для раскисления спокойной стали, разливаемой на машинах непрерывного литья заготовок, представлены для сплава со следующим. Химический составом: 48—54% Sі; 16—20% Мn; 6—12% Ва; 6—10% Са; 1,5—2,5% А1 и 8—13% Fе. Были исследованы также варианты раскисления стали с применением силикомарганца, ферросилиция, алюминия, титана. С целью более эффективного использования модифицирующего действия кальция и бария алюминий вводился раньше остальных раскислителей. Сплав KМБаК расходовали в количестве 5,8—5,0 кг/т стали. Титан присаживали в виде отходов, содержащих 98% Ті, после ввода раскислителей.
На основании результатов исследований были разработаны новые комплексные кремнекальцебариевые сплавы, содержащие алюминий и титан. При раскислении стали сплавом КМБаКАТ и присадке алюминия лишь 0,1 кг/т стали обеспечивалась удовлетворительная разливаемость стали, высокий уровень меха-нических свойств и удовлетворительное качество поверхности листа.
Для получения мелкозернистой стали широко применяется алюминий. В зависимости от содержания углерода в стали присадки алюминия могут составлять 0,06—0,12%. Из других элементов, способствующих получению мелкозернистой структуры, следует отметить ванадий. При его введении в сталь получается более однородное зерно, чем при раскислении стали алюминием.
Имеются данные, свидетельствующие о тормозящем действии выделений нитридов алюминия на рост зерна в углеродистой (0,2% С) и никелевой стали (3,5% Ni). Температура роста зерна с увеличением содержания [А1] для никелевой стали примерно на 70—90° С выше, чем для углеродистой.
Вредные элементы, содержащиеся в стали, способствуют возникновению неметаллических включений — сульфидов, нитридов, оксидов. Самая многочисленная группа неметаллических включений — оксиды. Значительную часть оксидных включений составляют SiO2 и Аl2О3, а также их производные — силикаты и алюминаты. Большинство неметаллических включений являются комплексными образованиями — алюмосиликатами, оксисульфидами, отнести их к определенной группе включений затруднительно.
По происхождению неметаллические включения делятся на две группы: эндогенные, т.е. выделяющиеся из расплава при кристаллизации и возникающие в процессе раскисления стали; экзогенные (внешнего происхождения), образующиеся в результате контакта жидкого металла с огнеупорной кладкой (наваркой) мартеновской печи, кислородного конвертера, сталеплавильного желоба, футеровкой сталеразливочного ковша.
На неметаллические включения в жидкой стали действуют выталкивающие силы, равные массе вытесненного ими металла. Для сферических включений в соответствии с законом Архимеда эта сила определяется из уравнения
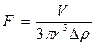 (6)
(6)
Включения, всплывающие под действием выталкивающей силы F, испытывают сопротивление стали
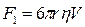 (7)
(7)
где η— вязкость стали; V — скорость перемещения включения относительно стали.
При условии равенства выталкивающих и тормозящих сил правые части уравнений (1) и (2) можно приравнять и после соответствующих преобразований получить значения величины скорости всплывания включений
 (8)
(8)
Формула (3) известна как формула Стокса. Она применима для условий ламинарного движения, которое наблюдается при малых значениях критерия Рейнольдса, и для малых частиц неметаллических включений (до 100 мк):
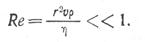
Для расчета скорости всплывания жидких включений следует пользоваться формулой Рыбчинского—Адамара:
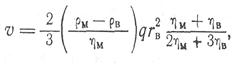 (9)
(9)
где гв -— радиус включений: р м>. p в, η в, η m — плотность и вязкость металла и включений соответственно. При наличии поверхностно-активных веществ скорость всплывания жидких капель может изменяться и вследствие эффекта торможения быть меньше рассчитанной по формуле Стокса.
Тормозящее влияние поверхностно-активных веществ может быть определено по уточненной формуле Стокса с учетом поверхностной вязкости:
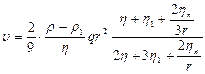 (10)
(10)
где ηn— коэффициент поверхностной вязкости, пропорциональный количеству адсорбированного вещества и изменению поверхностного натяжения в результате адсорбции; р, η, р 1, η1 — соответственно плотность и вязкость жидкой среды и капли.
Укрупнение неметаллических включений может происходить двумя путями:
- Слиянием нескольких отдельных образований в одно более крупное с исчезновением разделяющих поверхностей. Этот процесс называется коалесценцией и происходит при укрупнении в металле жидких включений и газовых пузырьков;
- Срастанием, спеканием или слипанием отдельных мелких образований, при которых разделяющие их поверхности не исчезают полностью. Такой процесс называется коагуляцией и протекает при двух или большем количестве твердых включений, а также при встрече капель малорастворимых жидкостей. К гетерофазной коагуляции относятся прилипание твердых или жидких включений к поверхности газовых пузырей, смачивание твердых включений каплями жидкости.
Движущей силой процесса укрупнения взвешенных в металле твердых, жидких или газообразных включений является изменение свободной энергии системы. Математическое выражение энергетического баланса слияния капель неметаллических включений имеет вид
ΔG = σм.в.·ΔW < 0 (11)
σм.в·Wм.в./ > σм.в·Wм.в.// (12)
где Wм.в./ и Wм.в./ — контактные поверхность металл — включение до и после слияния капель.
Коалесценция газовых пузырьков протекает при условии
σм.г·Wм.г./ > σм.г·Wм.г.// (13)
где Wм.г./ — межфазная поверхностная энергия на границе металл— газ; σм.ги Wм.г.// — контактные поверхности до и после слияния пузырьков. Неравенство в уравнениях (7) и (8) обеспечивается, так как W/ больше W".
Коагуляция твердых включений возможна при условии
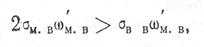
где Wм.в./ — часть всей поверхности включений, на которой происходит их контакт при встрече; σВ.В Wм.в./ — удельная поверхностная энергия на границе укрупняющихся включений.
Процессы укрупнения неметаллических включений связаны с температурой жидкой стали. С повышением температуры процессы укрупнения обычно ускоряются. Это обусловлено изменением динамической вязкости жидкого металла физических свойств самих включений.
§3. Диффузионное раскисление стали состоит в том, что раскисляющие вещества (молотый коксик, ферросилиций, силикокальций) вводятся на поверхность шлака. Плотность раскисляющих веществ такова, что часть из них находится на поверхности шлака, а часть—погружается в шлак, в котором происходит восстановление FеО по реакциям
1. FeO + C = Fe + CO;
2. 2FeO + Si = SiO2 + 2Fe
3. FeO + Ca = CaO + Fe
Минимально возможное остаточное содержание кислорода после диффузионного раскисления определяется из уравнения закона распределения
[%O] = 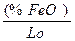 (1)
(1)
где [%0] — остаточное содержание кислорода в металле; (%-FеО) —содержание закиси железа в шлаке после завершения процесса его раскисления; Lо — коэффициент распределения кислорода между шлаком и металлом.
Из уравнения (1) следует, что степень диффузионного раскисления при заданной температуре зависит от концентрации закиси железа в шлаке. В дуговых электропечах низкое содержание FеО (<0,5%) в шлаке наблюдается в восстановительный период. В мартеновском процессе при диффузионном раскислении шлака содержание FеО редко снижается ниже 2—3%, при этом ванна продолжительное время не кипит, в результате чего повышается содержание водорода в металле.
Преимущество диффузионного раскисления стали перед осаждающим состоит в том, что в первом случае продукты раскисления не остаются в металле. Вместе с тем на диффузионное раскисление расходуется большое количество раскисляющих шлак веществ и требуется значительное время. Диффузионное раскисление осуществляется только при плавке стали в дуговых электропечах. Для уменьшения продолжительности восстановительного периода проводится предварительное осадочное раскисление.
По ходу восстановительного периода в шлаке понижается содержание не только FеО, но и МnО и Сr2О3. В зонах наиболее высоких температур под электрическими дугами происходит восстановление окиси кальция:
4. (CaO) + 3C(тв) = (СаС2) + {CO}
В белом шлаке электроплавки концентрация карбида кальция СаС2 не превышает 0,5%. С увеличением количества молотого кокса, расходуемого для раскисления шлака, содержание СаС2 в шлаке возрастает до 1,5—2% и такой шлак относится к карбидному.
Одновременно с понижением содержания FеО в шлаке при диффузионном раскислении постепенно уменьшается концентрация кислорода в стали. Так, при наличии в шлаке 0,5% FеО, температуре 1600°С, основности шлака (%СаО)/(%Sі02), равной двум, коэффициент распределения кислорода между шлаком и металлом составляет 166, а равновесная концентрация кислорода в металле [%О] =0,003%. Фактическая концентрация кислорода в металле близка к равновесной. Во время выпуска, разливки и затвердевания концентрация кислорода в стали повышается в результате взаимодействия струи стали с кислородом, а также вследствие ликвационных явлений, происходящих при затвердевании металла.
Опыт работы металлургических заводов и специально проведенные исследования показали, что при диффузионном раскислении равновесие металла и шлака практически не достигается, так как контактные поверхности двух смежных фаз незначительны: 1,5; 0,8; 0,4 м2/т стали соответственно для 5-, 10- и 30- тонных дуговых печей. Длительная выдержка металла под известковым восстановительным шлаком сопровождается крайне медленным снижением концентрации кислорода и существенным поглощением ванной азота и водорода, в результате чего ухудшается качество металла.
Наиболее характерные изменения условии массопереноса наблюдаются в восстановительный период электроплавки. Так, равномерное распределение радиоизотопа 59Fе в ванне 40-тонной электропечи в окислительный период достигается через 5—6 мин, а в восстановительный период (в раскисленной ванне) — через 60— 80 мин. Значения коэффициентов турбулентной диффузии в окислительный период составляют 57—146, а в восстановительный период при диффузионном раскислении — 0,5—2,4 см2/с. Эти величины были определены по данным распределения примесей в ванне электропечей емкостью 10, 40 и 100 т.
Более эффективно диффузионное раскисление протекает при обработке жидкой стали синтетическими шлаками, когда концентрация кислорода значительно снижается в течение 2—3 мин после образования шлакометаллической эмульсии, что обеспечивается чрезмерно развитой контактной поверхностью в системе шлак-металл, достигающей 500 м2/т стали.
Под вакуумом понимается состояние газовой среды с давлением ниже атмосферного. Различают низкий, средний и высокий (глубокий) вакуум в зависимости от давления газовой среды и соответствующей этому давлению величины средней длины свободного пробега газовых молекул:
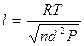 (2)
(2)
где d — диаметр газовой молекулы. Расчеты показывают, что при 20°С значения l для давления 0,133 Па составляют 0,051 м, а для давления 1,33-10~4 Па — 51 м.
Низкому вакууму соответствует давление газовой среды, при котором средняя длина свободного пробега газовых молекул значительно меньше линейных размеров вакуумного пространства, т.е. l<<I Соответственно для среднего вакуума l<<I, а для высокого — l>>I.
Отдельные виды вакуума характеризуются следующими границами давления: низкий вакуум — ниже 101,3 кПа до 13,3 Па; средний вакуум — от 13,3 Па до 1,33-10~2 Па; высокий вакуум — ниже 1,33-10-2Па.
§4. Теоретические расчеты и экспериментальные данные, полученные для реакций раскисления стали, показывают, что углерод является более слабым раскислителем, чем кремний и алюминий. Однако это справедливо для раскисления стали углеродом при атмосферном давлении. Если создать над жидким металлом давление ниже атмосферного, раскислительная способность углерода значительно увеличится.
Реакцию обезуглероживания в общем виде можно записать следующим образом:
1. [C]+[O] = CO
Kонстанта равновесия реакции 1
 (3)
(3)
где а с и а 0 — активности углерода и кислорода в металле. Так как константа равновесия реакции (1) при постоянной температуре является величиной постоянной, то с уменьшением величины парциального давления окиси углерода Рсо должна уменьшаться и величина а[С] а [0]. Это означает, что чем ниже давление Рсо, тем выше раскислительная способность углерода, тем меньше кислорода должно находиться в равновесии с углеродом.
Термодинамические расчеты Б.В.Линчевского показывают, что при 1600°С, давлении СО 133 Па и содержании углерода 0,1% в металле должно оставаться 3-10~5% кислорода. Такая низкая концентрация кислорода в металле не достигалась ни в одном из вакуумных металлургических процессов. Несоответствие расчетных и экспериментальных данных обусловлено кинетическими особенностями удаления СО из металла: содержание кислорода в металле определяется давлением СО в пузырьке, а не давлением СО над металлом. Давление СО в газовом пузырьке, образовавшемся в металле, значительно выше давления СО в газовой фазе над металлом. Поэтому для расчетов надо принимать давление СО в пузырьке, а не парциальное давление РСО над металлом. Ниже определенной величины Рсо раскислительная способность углерода перестает зависеть от снижения давления СО над металлом и остается постоянной величиной.
§5. Вакуумная обработка стали позволяет в лучшей степени использовать углерод как раскислитель, так как продуктами раскисления углеродом являются газообразные вещества СО и СО2, которые удаляются из сферы химического взаимодействия. Влияние разрежения (вакуума) на величину изобарно-изотермического потенциала реакции раскисления стали углеродом видно из следующего уравнения:
ΔGP.T = ΔG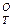 + RT lgP (4)
+ RT lgP (4)
где ΔG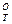 —изменение изобарного потенциала реакции обезуглероживания при постоянной температуре; Р — остаточное давление (разрежение), атм; ΔGP.T— изменение изобарного потенциала реакции обезуглероживания при учете изменяющегося остаточного давления.
—изменение изобарного потенциала реакции обезуглероживания при постоянной температуре; Р — остаточное давление (разрежение), атм; ΔGP.T— изменение изобарного потенциала реакции обезуглероживания при учете изменяющегося остаточного давления.
Так как величина Р меньше единицы, второй член уравнения (2) отрицательный. Чем значительнее снижение давления, тем суммарная убыль свободной энергии больше, в результате чего раскислительная способность углерода повышается. Однако такая зависимость будет правомернной до известного предела снижения давления СО над металлом, выше которого начинают оказывать влияние кинетические особенности реакции обезуглероживания металла в условиях вакуума.
Упругость диссоциации FеО в стали при 1600°С составляет 10~-6 кПа, что значительно ниже давления при вакуумной обработке стали 10~-3 кПа). Поэтому для удаления кислорода при вакуумной обработке стали необходимо использовать углерод.
Опытные данные активности растворенного в жидком железе кислорода а[О] от концентрации углерода, кремния, кальция и магния при 1600°С, при давлении окиси углерода 101,3 кПа углерод, содержащийся в стали в количестве 0,15%, снижает активность кислорода в такой же степени, как и 0,15% А1. Для давления окиси углерода 10,1 кПа рассмотренная зависимость наблюдается и для концентрации [Sі] и. [С], равной 0,003%.
Если концентрация углерода выше 0,003%,углерод при давлении ниже 10,1 кПа оказывает более сильное раскисляющее действие, чем кремний.
Раскислительная способность углерода при давлении 1 кПа раскислительной способности (при концентрациях более 0,15%). При любых давлениях окиси углерода и температуре 1600°С более сильными раскислителями, чем углерод, являются магний и кальций.
Из приведенных данных следует, что при раскислении стали углеродом в вакууме могут протекать процессы восстановления кремния и алюминия из огнеупорных материалов и неметаллических включений. Раскисление стали вакуумом позволяет значительно улучшить качество стали.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 590; Нарушение авторских прав?; Мы поможем в написании вашей работы!