
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная теория
|
|
|
|
В 1926 г. американский физико-химик Гилберт Льюис (1875 – 1946 гг.) предложил электронную теорию кислот и оснований.
По его теории к кислотам относятся вещества, являющиеся акцепторами электронной пары, а к основаниям — донорами электронной пары
Отличительным признаком этой теории является то, что кислота и основание взаимодействуют друг с другом с образованием связи по донорно-акцепторному механизму:
A +: B «A: B,
где – A — кислота,:B — основание, A: B — кислотно-основный комплекс (продукт нейтрализации).
В результате приобретения атомом, ответственным за кислотные свойства, электронной пары часто возникает завершенная электронная конфигурация. В отличие от электролитической и протолитической теорий, к кислотам относят соединения, не содержащие водород (апротонные кислоты).
Например:
: NH3 + – BF3 «NH3BF3,
– BF3 является кислотой.
Таблица 4
Некоторые примеры “реакций нейтрализации”
| Кислота | Основание | Кислотно-основный комплекс |
| H+ | OH– | H2O |
| CO2 | H2O | H2CO3 |
| AlCl3 | Cl– | [AlCl4]– |
| Zn(OH)2 | 2OH– | [Zn(OH)4]– |
| BF3 | NH3 | BF3 × NH3 |
| BF3 | (C2H5)2O | (C2H5)O × BF3 |
| SbCl5 | (C2H5)2O | SbCl5 × (C2H5)2O |
| Ag+ | 2CN | [Ag(CN)2]+ |
Понятия основания в теориях Бренстеда (протолитическая теория) и Льюиса совпадают, однако понятие кислоты в электронной теории охватывает, кроме протона, более широкий круг частиц способных акцептировать электронную пару.
Растворение кислот Льюиса в ионизирующих растворителях (например, в H2O) приводит к росту концентрации ионов водорода (катионов гидроксония):
AlCl3 + 2 H2O «Al(OH)Cl2 + H3O+ + Cl –
SO3 + 2 H2O «H3O+ +  .
.
Растворение оснований Льюиса в воде приводит к увеличению концентрации анионов OH–:
NH3 + H2O « + OH –
+ OH –
(CH3)NH2 + H2O «(CH3)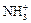 + OH –.
+ OH –.
Кислотные свойства ортоборной кислоты H3BO3 обусловлены не электролитической диссоциацией этого соединения, а образованием катионов гидроксония (H3O+) по реакции:
H3BO3 + 2 H2O «[B(OH)4] – + H3O+.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 297; Нарушение авторских прав?; Мы поможем в написании вашей работы!