
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения кислот
|
|
|
|
Классификация кислот.
Кислоты
Здесь будут рассмотрены соединения, являющиеся кислотами с позиции электролитической теории.
Классификация кислот может быть проведена по различным признакам.
1°. Кислоты неорганические (HNO3 , H2SO4 и др.) и органические (CH3COOH, C2O4H2 и др.). Далее в этом разделе будем рассматривать неорганические кислоты.
2°. По содержанию кислорода в кислотном остатке:
а) бескислородные — H n X, где X — галоген, халькоген или неорганический радикал типа CN, NCS и др. Например, HCl, H2S, HCN.
б) кислородсодержащие (оксокислоты), с общей формулой H n ЭO m, где Э — кислотообразующий элемент. Некоторые оксокислоты могут содержать несколько атомов кислотообразующего элемента, например H4P2O7, H2S2O7. При этом однотипные фрагменты связаны через атом кислорода: Э—О—Э, В таких кислотах одинаковые фрагменты могут образовывать как открытые цепи, например, H2S2O7, так и циклические структуры, например, (HPO3) n:
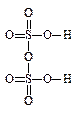 Пиросерная кислоита
Пиросерная кислоита
| 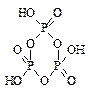 Метафосфорная кислота
Метафосфорная кислота
|
Оксокислоты характерны для многих химических элементов, особенно для элементов в высоких степенях окисления (+3 и выше).
3°. По основности. Основность кислот — число ионов водорода, которые отщепляются от молекулы кислоты при ее диссоциации или обмениваются на катионы металла при взаимодействии кислоты с основанием или с металлом.
По основности кислоты делятся на одноосновные (HNO3, HCl) двухосновные (H2SO4), трех- (H3PO4) и т. д.
Преимущественно в оксокислотах атомы водорода связаны с атомами кислорода, а не с центральным атомом аниона. Именно эти атомы водорода и отщепляются при диссоциации кислоты в водном растворе с образованием катионов гидроксония (H3O+) и принимают участие в реакции нейтрализации т. е. определяют основность кислоты. Для неорганических кислот, как правило, общее число атомов водорода в молекуле соответствует основности кислоты, но это не всегда так.
В некоторых кислотах есть атомы водорода связанные непосредственно с атомом кислотообразующего элемента, такие атомы водорода не обмениваются на ион металла, т. е. не определяют основность кислоты.
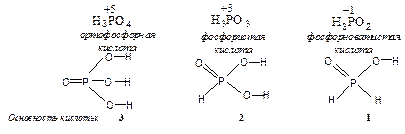
Для органических кислот общее число атомов водорода в молекуле, в подавляющем большинстве случаев, не соответствует основности кислоты. Основность органических кислот определяется числом карбоксильных групп в молекуле, например,
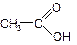 уксусная одноосновная кислота
уксусная одноосновная кислота
| 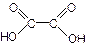 щавелевая двухосновная кислота
щавелевая двухосновная кислота
|
Многоосновные кислоты диссоциируют ступенчато и могут образовывать несколько рядов солей, например, серная кислота — кислота двухосновная, диссоциирует по двум ступеням:
H2SO4 «H+ + 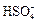 «2H+ +
«2H+ + 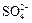
образует два ряда солей:
сульфаты (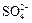 ), например, Na2SO4 — сульфат натрия,
), например, Na2SO4 — сульфат натрия,
гидросульфаты (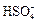 ), например, NaHSO4 — гидросульфат натрия или кислый сульфат натрия.
), например, NaHSO4 — гидросульфат натрия или кислый сульфат натрия.
4°. Сила кислот. Сила кислоты (как и любого другого электролита) определяется степенью диссоциации, a, которая равна отношению количества продиссоциировавших молекул к общему количеству молекул данного электролита в растворе, т. е. долю продиссоциировавших молекул, ее можно также выражать в процентах:
a =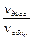
| ´ 100% |
Для характеристики силы электролитов применяют также константу диссоциации (константу равновесия реакции диссоциации):
HAn + H2O «H3O+ + An–
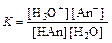 .
.
Так как концентрацию воды в водных растворах можно принять за постоянную величину, ее можно включить в константу равновесия:
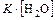 =
= 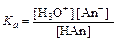 .
.
Величину Ka называют константой ионизации кислоты (индекс «а» — от английского acid — кислота), в числителе обычно указывают не концентрацию катионов гидроксония, а концентрацию ионов водорода.
Качественно силу кислот можно оценить по правилу Полинга: если представить формулу оксокислоты в общем виде — H n ЭO m , то по разности (m – n) можно оценить силу кислоты: у какой кислоты она больше та кислота и сильнее:
m – n = 0 — кислота очень слабая, HClO
m – n = 1 — кислота слабая, HClO2
m – n = 2 — кислота сильная, HClO3
m – n = 3 — кислота очень сильная, HClO4.
Для многоосновных кислот для каждой ступени диссоциации можно записать свою константу ионизации, причем, как правило, каждая последующая константа меньше предыдущей на несколько порядков:
K 1 >> K 2 >> K 3
(например, для фосфорной кислоты K 1 = 7 × 10–3, K 2 = 6 × 10–8,
K 3 = 5, × 10–13).
Замена одного атома кислорода в оксокислоте на атом фтора ведет к резкому увеличению силы кислоты. Примером может служить фторсульфоновая кислота HSO3F. Такие кислоты получили название суперкислот. К этому же классу кислот относятся и кислоты с комплексным анионом, например HSbF6.
5°. По устойчивости. Некоторые оксокислоты существуют только в водных разбавленных растворах и являются термически неустойчивыми. Получить их в индивидуальном виде невозможно, например H2CO3, H2SO3, HClO, HClO2. В то же время есть устойчивые к нагреванию кислоты, например, серная H2SO4 (t кип. = 296,5°С).
6°. По растворимости. По растворимости кислоты делятся на растворимые, такие как HNO3, H3PO4, и нерастворимые в воде — SiO2 × x H2O, H2MoO4.
7°. По соотношению воды и кислотного оксида. По этому признаку кислоты делятся на орто -, пиро -, мета -кислоты и кислоты переменного состава.
К орто-кислотам относятся кислоты, в которых отношение воды и кислотного оксида превышает 1. К таким кислотам относятся ортофосфорная H3PO4 [n(H2O): n(P2O5) = 3: 1].
В мета-кислотах это отношение равно 1, например, метафосфорная кислота HPO3 [n(H2O): n(P2O5) = 1: 1]. К этим же кислотам относятся азотная, серная и многие другие.
Пиро-кислоты получаются из орто-кислот в результате отщеплением воды при нагревании:
2H3PO4 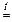 H4P2O7 + H2O
H4P2O7 + H2O
или растворением кислотного оксида в кислоте:
H2SO4 + SO3 = H2S2O7.
Свои названия эти кислоты получили от греческого слова pyr — огонь.
В некоторых кислотах отношение воды и кислотного оксида зависит от способа получения, например, x SiO2 × y H2O; x TiO2 × y H2O. x SnO2 × y H2O. Чаще всего они встречаются в виде коллоидных растворов.
1. Бескислородые кислоты могут быть получены:
а) взаимодействием простых веществ с водородом
H2 + Cl2 = 2HCl
при горении водорода в атмосфере хлора
H2 + S 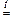 H2S,
H2S,
б) при горении органических галогенсодержащих соединений
2 CH3Cl + 3 O2 ® 2 CO2 + 2 H2O + 2 HCl,
в) при реакции алканов с галогенами:
CH4 + Cl2 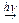 CH3Cl + HCl,
CH3Cl + HCl,
2. Кислородсодержащие кислоты чаще всего получают растворением кислотного оксида в воде (если кислота растворима в воде):
SO3 + H2O = H2SO4.
В случае, если кислота нерастворима в воде этот способ не применим, например:
SiO2 + H2O ¹
WO3 + H2O ¹.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1471; Нарушение авторских прав?; Мы поможем в написании вашей работы!