
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства кислот
1°. Рассмотрим характерные свойства кислот, не являющихся окислителями.
1°.1. Реакции обмена
а) Взаимодействие с основаниями (как с растворимыми, так и с нерастворимыми) — реакция нейтрализации:
NaOH + HCl = NaCl + H2O
Cu(OH)2 ¯ + H2SO4 = CuSO4 раствор + 2 H2O.
б) Взаимодействие с солями
BaCl2 + H2SO4 = BaSO4 ¯ + 2HCl
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O.
При составлении уравнений реакций обмена необходимо учитывать условия протекания этих реакций до конца:
а) образование хотя бы одного нерастворимого соединения
б) выделение газа
в) образование слабого электролита (например, воды)
1°.2. Реакции с основными и амфотерными оксидами:
а) FeO + H2SO4 = FeSO4 + H2O
б) ZnO + 2 HNO3 = Zn(NO3)2 + H2O.
1°.3. Металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют водород из кислот, не являющихся сильными окислителями (HCl, H2SO4 (разб.)):
Zn + H2SO4 (разб.) = ZnSO4 + H2
Mg + 2 HCl = MgCl2 + H2.
Если в результате реакции образуется нерастворимая соль или оксид, то металл пассивируется и его растворение не происходит:
Pb + H2SO4 ¹
(PbSO4 — нерастворим в воде)
Al + HNO3 (конц.) ¹
(поверхность металла покрывается оксидной пленкой).
1°.4. Термически неустойчивые кислоты, например, угольная, сернистая, разлагаются при комнатной температуре или при легком нагревании:
H2CO3 = CO2 + H2O
H2SO3 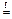 SO2 + H2O
SO2 + H2O
SiO2 × x H2O 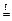 SiO2 + x H2O .
SiO2 + x H2O .
1°.5. Реакции с изменением степени окисления кислотообразующего элемента.
4 + MnO2 = MnCl2 +
+ MnO2 = MnCl2 + 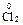 + 2 H2O
+ 2 H2O
 + H2O2 =
+ H2O2 =  + H2O
+ H2O
2 + Cu = CuSO4 +
+ Cu = CuSO4 +  + 2 H2O
+ 2 H2O
2 H2S + H2SO3 = 3 S ¯ + 3 H2O.
По этому принципу кислоты можно разделить на кислоты-восстановители и кислоты-окислители.
|
|
Дата добавления: 2014-01-05; Просмотров: 816; Нарушение авторских прав?; Мы поможем в написании вашей работы!