
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства кислот-окислителей
|
|
|
|
2°.1. Реакции обмена. Кислоты-окислители реагируют с оксидами, гидроксидами и солями, в состав которых входят катионы металлов не проявляющих переменные степени окисления также как и кислоты, не являющиеся окислителями (см. 1 °. 1 и 1 °. 2 в п. 2.4).
2°.2. Реакции с гидроксидами, оксидами и солями.
а) Если металл, образующий основание, может находиться в нескольких степенях окисления, а кислота проявляет окислительные свойства, то эти реакции могут протекать с изменением степеней окисления элементов, например:
Fe(OH)2 + 4 HNO3 (конц.) = Fe(NO3)3 + NO2 + 3 H2O.
б) Аналогично ведут себя в реакциях с кислотами-окислителями и оксиды металлов, проявляющих переменные степени окисления:
2 FeO + 4 H2SO4 (конц.) = Fe2(SO4)3 + SO2 + 4 H2O.
в) При реакциях кислот-окислителей с солями, содержащими анион, проявляющий восстановительные свойства, происходит его окисление:
3 Na2S + 8 HNO3 (разб.) = 6 NaNO3 + 3 S ¯ + 2 NO + 4 H2O
8 NaI + 5 H2SO4 (конц.) = 4 I2¯+ H2S + 4 Na2SO4 + 4 H2O.
2°.3. Взаимодействие с металлами.
Азотная и концентрированная серная кислоты являются сильными окислителями и могут взаимодействовать с металлами, стоящими в ряду напряжений как до, так и после водорода, но водород в этом случае не выделяется, а образуются продукты восстановления азота и серы, причем, состав продуктов зависит от активности металла, концентрации кислоты и температуры:
Cu + 4 HNO3 (конц.) = Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8 HNO3 (разб.) = 3 Сu(NO3)2 + 2 NO + 4 H2O
5 Co + 12 HNO3 (оч.разб.) = 5 Co(NO3)2 + N2 + 6 H2O
4 Zn + 10 HNO3 (оч.разб.) = 4 Zn(NO3)2 + NH4NO3 + 3 H2O.
С разбавленной серной кислотой медь не взаимодействует, но реагирует с концентрированной серной кислотой, однако водород при этом не выделяется:
Cu + 2 H2SO4 (конц.) = CuSO4 + SO2 +2 H2O.
Некоторые металлы, стоящие в ряду напряжений до водорода, например, Fe, Al, Cr, эти кислоты пассивируют за счет образования на поверхности металла оксидной пленки нерастворимой в концентрированных кислотах при обычных условиях и поэтому указанные металлы не взаимодействуют с концентрированными серной и азотной кислотами.
2°.4. Реакции с неметаллами. Концентрированные азотная и серная кислоты взаимодействуют с неметаллами: серой, фосфором, углеродом:
S + 2 HNO3 (конц.) 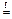 H2SO4 + 2 NO
H2SO4 + 2 NO
S + 2 H2SO4 (конц.) 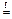 3 SO2 + 2 H2O
3 SO2 + 2 H2O
3 P + 5 HNO3 (конц.) + 2 H2O 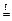 3 H3PO4 + 5 NO
3 H3PO4 + 5 NO
C + 2 H2SO4 (конц.) 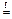 CO2 + 2 SO2 + 2 H2O.
CO2 + 2 SO2 + 2 H2O.
2°.5. Кислоты, образованные переходными металлами в высших степенях окисления, например, хромовая [H2CrO4], марганцовая [HMnO4], являются сильными окислителями.
2 H2CrO4 + 3 SO2 = Cr2(SO4)3 + 2 H2O.
Кислоты, в которых кислотообразующий элемент находится в промежуточной степени окисления могут проявлять как окислительные, так восстановительные свойства.
H2SO3 + 2 H2S = 3 S ¯ + 3 H2O (H2SO3 — окислитель)
H2SO3 + NO2 = H2SO4 + NO (H2SO3 — восстановитель).
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 7646; Нарушение авторских прав?; Мы поможем в написании вашей работы!