
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства солей
|
|
|
|
Соли могут взаимодействовать:
1°. С кислотами или с кислотными оксидами (сильная или малолетучая кислота вытесняет слабую или более летучую, неустойчивую кислоту из соли):
KCN + HCl = KCl + HCN
 +
+ 
 KHSO4 + HClO4
KHSO4 + HClO4
Na2CO3 + SiO2 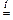 Na2SiO3 + CO2 .
Na2SiO3 + CO2 .
2°. С основаниями (сильное или менее летучее основание вытесняет слабое или более летучее основание из солей):
FeSO4 + 2NaOH = Fe(OH)2 ¯ + Na2SO4
NH4Cl + KOH = NH3 + H2O + KCl
[CH3NH3]Cl + NaOH = CH3NH2 + NaCl + H2O.
3°. С солями:
AgNO3 + NaCl = AgCl¯ + NaNO3.
При составлении уравнений реакций обмена между электролитами, необходимо учитывать условия протекания реакций до конца и пользоваться таблицей растворимости оснований, кислот и солей.
4°. С металлами, стоящими в электрохимическом ряду напряжений до металла, катион которого входит в состав соли (см. «получение солей» п. 3):
2 AgNO3 + Cu = 2 Ag ¯ + Cu(NO3)2.
При составлении уравнений подобных реакций не следует использовать металлы, стоящие в ряду электрохимических напряжений до магния, т. к. эти металлы прежде всего будут взаимодействовать с водой в результате чего образуется гидроксид, который и будет реагировать с солью, например, раствор CuSO4 + Na
2 Na + 2 H2O = 2 NaOH + H2
2 NaOH + CuSO4 = Cu(OH)2¯ + Na2SO4.
5°. Соли кислородсодержащих кислот разлагаются при нагревании:
2Cu(NO3)2 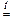 2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
CaCO3 = CaO + CO2 (при t > 900°C).
6°. Если кислотообразующий элемент может находиться в нескольких степенях окисления, то используя подходящий окислитель или восстановитель можно перейти от соли одной кислоты к соли другой кислоты, в которой кислотообразующий элемент находится в другой степени окисления.
Na2SO3 + H2O2 = Na2SO4 + H2O.
Аналогично, если металл, входящий в состав соли может проявлять различные степени окисления, то можно перейти от одной соли к другой, в которой металл находится в иной степени окисления:
3 Fe(NO3)2 + 4 HNO3  3 Fe(NO3)3 + NO + 2 H2O
3 Fe(NO3)3 + NO + 2 H2O
2 FeCl3 + Cu = 2 FeCl2 + CuCl2.
Оглавление
Глава 1. Оксиды.................................................................................
§ 1. Физические свойства оксидов................................................................................
§ 2. Классификация оксидов и закономерности изменения химических свойств.....
2.1. Классификация оксидов по химическим свойствам.................................
2.2. Закономерности изменения свойств оксидов...........................................
§ 3. Способы получения оксидов..................................................................................
§ 4. Химические свойства оксидов...............................................................................
4.1. Основные оксиды.........................................................................................
4.2. Кислотные оксиды.....................................................................................
4.3. Амфотерные оксиды.................................................................................
4.4. Общие химические свойства оксидов......................................................
Глава 2. Кислоты и основания.........................................................
§ 1. Теории кислот и оснований..................................................................................
1.1. Электролитическая теория.....................................................................
1.2. Протолитическая теория........................................................................
1.3. Электронная теория.................................................................................
§ 2. Кислоты.................................................................................................................
2.1. Классификация кислот.............................................................................
2.2. Способы получения кислот.......................................................................
2.3. Общие методы получения любых кислот...............................................
2.4. Химические свойства кислот...................................................................
§ 3. Основания..............................................................................................................
3.1. Классификация оснований........................................................................
3.2. Способы получения оснований..................................................................
3.3. Химические свойства оснований..............................................................
Глава 3. Соли...................................................................................
§ 1. Классификация солей...........................................................................................
§ 2. Способы получения солей....................................................................................
§ 3. Химические свойства солей.................................................................................
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 602; Нарушение авторских прав?; Мы поможем в написании вашей работы!