
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм электрофильного замещения
|
|
|
|
Химические свойства
Физические свойства ароматических углеводородов
Фазовое состояние – жидкие или твердые вещества.
Простейший ароматический углеводород – бензол – имеет Ткип=600С. В воде нерастворимы. Обладают более высокими значениями d204 и n20d среди остальных углеводородов с тем же числом атомов углерода.
| Название | d204 | n20d |
| Парафины | 0,41-0,76 | 1,34-1,43 |
| Нафтены | 0,68-0,85 | 1,37-1,46 |
| Ароматические углеводороды | 0,86-0,93 | 1,49-1,52 |
Горят сильным коптящим пламенем. Ядовиты для организма. При частом вдыхании паров обладают способностью кумулироваться в организме, поражая нервную систему. Среди углеводородов являются самыми вредными.
Ароматические углеводороды обладают довольно высокой реакционной способностью. Следует выделить 3 основных вида химических реакций ароматических углеводородов: 1) в основном, это реакции замещения, а также 2) присоединения; 3) окисления.
1) наиболее распространенным видом реакций ароматических углеводородов являются реакции электрофильного замещения. К ним относятся реакции галогенирования, нитрования, сульфирования, алкилирования (Фриделя-Крафтса), ацилирования и т.д. Общим во всех этих реакциях является то, что они идут при действии на ароматическое электрофильных (положительно заряженных) реагентов Х+.
Можно рассмотреть на примере реакции Фриделя-Крафтса.
CH3:Cl + AlCl3 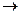 CH3+ [AlCl4]-
CH3+ [AlCl4]-

|
+ CH3+ 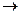
| 
| или | 
|
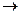
|
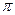 -комплекс -комплекс
|
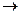
| 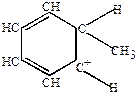
|
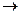
| 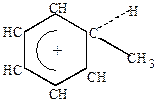
|
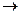 H+ + H+ +
| 
|
| карбоний-ион А | 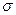 -комплекс -комплекс
|
H+ + AlCl4-  HCl + AlCl3
HCl + AlCl3
Отдельные стадии электрофильных реакций замещения:
1) образование 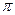 -комплекса -
-комплекса - 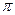 -связи не разрываются, реагент образует донорно-акцепторные связи со всеми шестью атомами углерода.
-связи не разрываются, реагент образует донорно-акцепторные связи со всеми шестью атомами углерода.
2) образование карбоний-иона – реагент “вытягивает” пару 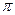 -электронов из шестиэлектронного секстета и образует
-электронов из шестиэлектронного секстета и образует 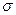 -связи.
-связи.
3) образование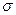 -комплекса – выравнивание электронной плотности в кольце. Положительный заряд распределяется между пятью группами СН.
-комплекса – выравнивание электронной плотности в кольце. Положительный заряд распределяется между пятью группами СН.
4) выброс протона.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 482; Нарушение авторских прав?; Мы поможем в написании вашей работы!