
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пероксид водорода
|
|
|
|
Вода
Бесцветная жидкость (слой более 5м толщиной окрашен в голубой цвет), без вкуса и запаха. Молекула имеет строение незавершенного тетраэдра. Летучее вещество, термически устойчивое до 1000°С.
В обычных условиях полярные молекулы воды образуют между собой водородные связи. Это обусловливает аномалию температур плавления и кипения воды – они значительно выше, чем у ее химических аналогов (сероводорода и других). Затвердевание воды в лед сопровождается увеличением объема на 9%, т.е. лед легче жидкой воды (вторая аномалия воды). Наибольшую плотность вода имеет не при 0°С, а при 4°С (третья аномалия воды). Твердая вода легко возгоняется.
В газовой фазе молекулы воды имеют угловое строение (угол = 104,5°, длина связи О-Н = 96 нм).
Водяной пар является катализатором многих процессов. Для осушки жидкостей и газов используют различные поглощающие воду вещества: P2O5, Mg(ClO4)2, H2SO4, CaO, CaCl2, KOH, NaOH и др. Каждое из них позволяет уменьшить содержание воды до определенного предела, соответствующего давлению насыщенного водяного пара над гидратированным осушителем. Для удаления следов воды часто используются цеолиты.
Молекулы воды в малой степени подвергаются автодиссоцииации до Н+, или точнее до Н3О+ и ОН-; очень слабый электролит. Катион оксония Н3О+ имеет строение незавершенного тетраэдра. Образует гидраты со многими солями, аквакомплексы – с катионами металлов. Реагирует с металлами, неметаллами, оксидами. Вызывает электролитическую диссоциацию кислот, оснований и солей, гидролизует многие бинарные соединения и соли. Подвергается электролизу в присутствии сильных электролитов. Универсальный жидкий растворитель неорганических соединений.
Для химических целей природную воду очищают перегонкой (дистиллированная вода), для промышленных целей умягчают, устраняя временную и постоянную жесткость, или полностью обессоливают, пропуская через иониты в кислотной Н+- форме и щелочной ОН--форме (ионы солей осаждаются на ионитах, а ионы Н+ и ОН- переходят в воду и взаимно нейтрализуются). Питьевую воду обеззараживают хлорированием (старый способ) или озонированием (современный, но дорогой способ; озон не только окисляет вредные примеси подобно хлору, но и увеличивает содержание растворенного кислорода).
Уравнения важнейших реакций:
H2O + Cl2 ↔ HClO + HCl (на холоду)
2H2O + 2Na = 2NaOH + H2↑
6H2O + 2NaOH(конц.) + 2Al = 2Na[Al(OH)4] + 3H2↑ (80°С)
H2O + Na2O = 2NaOH(р) = 2Na+ + OH- (рН>7)
H2O + CaO = Ca(OH)2(т) ↔ Ca(OH)2(р) = Ca2+ + 2OH- (рН>7)
3H2O + SO3 = H2SO4(р) + 2H2O = 2H3O+ + SO42- (рН<7)
Примеры гидролиза бинарных соединений:
6H2O + Al2S3 = 2Al(OH)3↓ + 3H2S↑ (40-60°С) 2H2O + SF4 = SO2↑ + 4HF↑ (кипячение)
6H2О + Mg3N2 = 3Mg(OH)2↓ + 2NH3↑
2H2O + CaC2 = Ca(OH)2↓ + C2H2↑
Вода – окислитель:
H2O + Cкокс = CO + H2 (800-1000°С)
2H2O + CaH2 = Ca(OH)2↓ + 2H2↑
Электролиз воды:
2H2O = 2H2↑ + О2↑
Электропроводность чистой (дистиллированной) воды весьма мала, поэтому электролиз проводят в присутствии сильных электролитов.
а) в нейтральном растворе (электролит Na2SO4):
катод 2Н2О + 2ē = Н2↑ + 2ОН-
анод 2Н2О -4ē = О2↑ + 4Н+
раствор ОН- + Н+ = Н2О
б) в кислом растворе (электролит H2SO4):
катод 2Н+ + 2ē = Н2↑
анод 2Н2О -4ē = О2↑ + 4Н+
в) в щелочном растворе (электролит NaOH):
катод 2Н2О + 2ē = Н2↑ + 2ОН-
анод 4ОН- -4ē = О2↑ + 2Н2О
Один из методов обнаружения воды основан на переходе во влажной атмосфере белого сульфата меди (II) CuSO4 в голубой медный купорос CuSO4*5Н2О.
Известна аллотропная разновидность воды – тяжелая вода D2O (2Н2О); в природных водах массовое отношение D2O: Н2О = 1: 6000. Плотность, температуры плавления и кипения тяжелой воды выше, чем у обыкновенной. Растворимость большинства веществ выше в тяжелой воде значительно меньше, чем в обычной воде. Она ядовита, так как замедляет биологические процессы в живых организмах. Тяжелая вода накапливается в остатке электролита при многоразовом электролизе воды. Используется как теплоноситель и замедлитель нейтронов в ядерных реакторах.
Бинарное соединение. Молекула Н2О2 неплоская, имеет строение
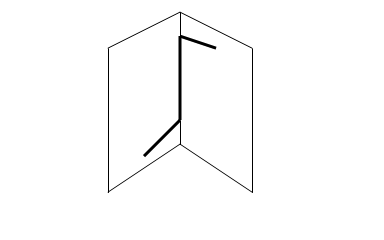
с σ-связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна -1, валентность равна 2. Группа – О – О – называется пероксигруппой (пероксидный мостик). Молекула полярна.
Бесцветная жидкость, вязкая (это обусловлено развитой системой водородных связей), тяжелее воды, чувствительна к свету и примесям (стабилизатор Н3РО4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель.
Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из-за перехода белил – гидроксикарбонатов свинца – в черный PbS осветляют переводом в белый PbSО4). В промышленности обычно используют взрывобезопасный 30%-ный раствор (пергидроль), в медицине – 3%-ный раствор.
Уравнения важнейших реакций:
2H2O2 = 2H2O + O2 (выше 150°С или на кат. MnO2)
H2O2(разб.) + NaOH(разб.) = NaHO2 + H2O
H2O2(конц.) + 2NaOH(т) = Na2O2↓+ 2H2O (0°С)
H2O2(3%) + 2H+ + 2I- = I2↓ + 2H2O
5H2O2 (30%) + I2(т) = 2HIO3 + 4H2O
H2O2 (10%) + SO32- = SO42- + H2O
4H2O2(30%) + PbS(черн.) = 4H2O + PbSО4 (бел.)↓
H2O2 + OH- + [Sn(OH)3]- = [Sn(OH)6]2-
3H2O2 + 2[Cr(OH)6]3- = 2СrO42- + 8H2O + 2OH-
H2O2(конц.) +Ag2O = 2Ag↓ + O2↑ + H2O
2H2O2(клнц.) + Ca(ClO)2 = CaCl2 + 2H2O +2O2↑
5H2O2 + 6H2SО4 + 2КMnO4 = 2MnSО4+ 5O2↑+ 8H2O + К2SО4
Получение: в лаборатории вначале синтезируют пероксид бария:
2BaO + O2(изб.) = 2BaO2 (до 500°С)
а затем его обрабатывают серной кислотой на холоду:
BaO2 + H2SO4 = BaSO4↓ + H2O2
В промышленности (старый метод) – электролиз водного раствора серной кислоты или сульфата аммония в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде пероксид водорода:
2 H2O → H2 + H2O2
Современный промышленный способ – окисление 2-этилантрагидрохинона кислородом воздуха на холоду:

2-этилантрагидрохинон 2-этилантрахинон
Еще один промышленный способ – каталитическое окисление изопропилового спирта, ценным побочным продуктом реакции является ацетон:
(СН3)2СН(ОН) + О2 → СН3СОСН3 + Н2О2
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 750; Нарушение авторских прав?; Мы поможем в написании вашей работы!