
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конфигурации вещества хироптическими методами
|
|
|
|
Установление пространственного строения или абсолютной
Определение абсолютной конфигурации вещества всегда было для химика-органика важной и увлекательной проблемой. Решение этой проблемы сильно упростилось с появлением хироптических методов. Рассмотрим два общих способа.
11.4.1. Метод сравнения.
Этот метод основан на том, что спектр (ДОВ или КД) соединения с неизвестной конфигурацией сравнивается со спектром соединения с известной конфигурацией. Сравнение дает результат, если выполняются следующие условия:
· Хромофорная (поглощающая излучение) группа в сравниваемых веществах должна быть одной и той же;
· Ближнее асимметричное окружение (ближних двух колец в полициклических системах) также должно быть одним и тем же.
Влияние же удаленных от хромофора групп незначительно, поэтому их строением можно пренебречь.
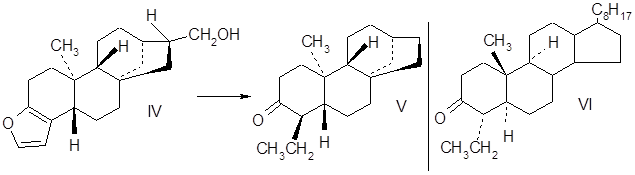 |
Если же первые два условия не выполняются, тогда вещество неизвестной конфигурации химическими методами без изменения конфигурации асимметричных центров превращают в соединение, для которого указанные два условия выполняются. В качестве примера установления абсолютной конфигурации можно привести кафестол (дитерпен, содержащийся в бобах кофе). Фурановое кольцо кафестола IV было превращено в этилкетонную группировку и удалена дальняя группа СН2ОН, в результате было получено вещество V:
Спектр ДОВ кетона V сравнили со спектром ДОВ 4-a-этилхолестанона-3 (VI), конфигурация которого хорошо известна. Спектр кетона V – 1(V) и спектр вещества VI – 2(VI) предствлены на рисунке в начале следующей страницы:
Сравнение кривых ДОВ 1 и 2, что они практически являются зеркальным отображением друг лруга. Отсюда следует, что конфигурация кафестола антиподна конфигурации 4-a-этилхолестанона-3.
 |
11.4.2. Правило октантов.
11.4.2.1. Сущность правила октантов.
 Это правило применяется для анализа строения кетонов методами ДОВ и КД по той простой причине, что np p* находится в очень удобном для изменения интервале длин волн и мало интенсивен, ибо запрещен локальной симметрией. Наблюдение спектров этого перехода очень удобно технически.
Это правило применяется для анализа строения кетонов методами ДОВ и КД по той простой причине, что np p* находится в очень удобном для изменения интервале длин волн и мало интенсивен, ибо запрещен локальной симметрией. Наблюдение спектров этого перехода очень удобно технически.
В пространстве, поделенном тремя взаимно перпендикулярными плоскостями на 8 частей (октантов), карбонильные соединения размещаются таким образом, чтобы плоскости симметрии орбиталей, образующих карбонильную группу (плоскости А и В, делящие пространство на октанты, одновременно являются плоскостями симметрии s2v точечной группы С2v, к которой принадлежит формальдегид и симметричные кетоны типа циклогексанона, плоскость же С является узловой плоскостью анти связывающей p*-орбитали:
|
Передние задние
Октанты октанты

 В В
В В
- + + -

 А А
А А
+ - - +
Все атомы, которые лежат на пересекающихся линиях или плоскостях, не вносят вклад в оптическую активность соединения, атомы же, не лежащие на плоскостях и линиях, вносят положительный вклад, если они находятся в октантах со знаком +, отрицательный, если они находятся в октантах со знаком -. Пространственное строение сложной молекулы неудобно показывать на плоскости, поэтому молекулу изображают в виде плоской проекции, лежащей на плоскости, параллельной плоскости С. Всегда смотрят на молекулу со стороны кислорода вдоль оси пересечения плоскостей А и В, поэтому изображения атомов О и С (С=О связи) сливаются в одну точку, причем в этой двойной точке впереди стоит атом кислорода.
Атомы, расположенные в передних октантах, обозначаются подчеркнутыми снизу номерами, а связи между ними – пунктирными линиями. Однако, такая ситуация встречается весьма редко, в подавляющем большинстве соединений все атомы находятся в задних октантах, обозначаются они не подчеркнутыми цифрами, а связи между ними пишутся сплошной линией.
11.4.2.2. Правило октантов и замещенные циклогексаноны.
Простейший анализ можем провести для 3-метилциклогексанона, который существует в виде пары антиподов, каждый из которых имеет две конформации, находящиеся в динамическом равновесии:
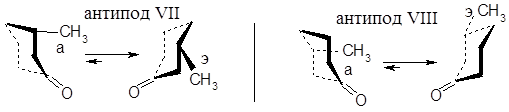
На основании того, что метилциклогексан находится практически весь в наиболее выгодной экваториальной конформации, то, очевидно, то же самое касается и конформаций 3-метилциклогексанона с экваториальным положением метильных групп.
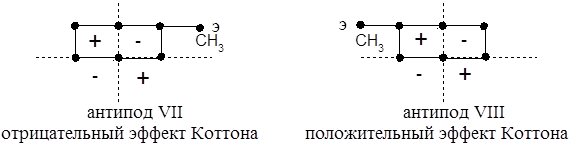 |
Построим проекции наиболее устойчивых конформаций антиподов 3-метилциклогексанона:
Находящиеся в верхнем правом октанте антипода VII два углеродных центра вносят два отрицательных вклада, и только один из них компенсируется положительным вкладом одного углеродного центра в левом октанте, в результате чего и имеет место общий отрицательный эффект. Для антипода VIII применимо то же рассуждение, только и октанты и знаки эффекта меняются на противоположные. Конфигурации и знаки вращения диастереомеров 3-метилциклогексанона известны задолго до появления правила октантов и они совпадают с выводами, вытекающими из правила октантов.
Вернемся к транс-2-хлор-5-метилциклогексанона и построим для его конформеров IIIa и IIIb проекции в соответствии с правилом октантов, представленные в начале следующей страницы:
 |
Как показывает оценка сумм вкладов в эффект Коттона группы СН3 и атома Сl, суммарные эффекты, как и следует ожидать, противоположны, причем в случае раствора в изооктане наличия всего 18% диаксиальной формы (против 1% в метаноле) достаточно, чтобы перевесить воздействие 82% диэкваториальной формы. Поскольку объем хлора превышает объем метильной группы, то и его вклад в эффект Коттона существенно больше.
11.4.2.3. Правило октантов и 3-кетостероиды.
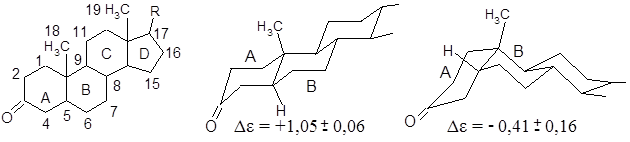
Рассмотрим более сложный пример А/В-транс и А/В-цис-3-кетостероидов(здесь приведены данные по спектру КД):
Проводим оценку эффекта Коттона в соответствии а правилом октантов, для чего пользуемся проекциями первых двух колец (ближнее окружение) хромофорной группы (СО) рассматриваемых изомеров:
|
De = + 4а + (-а) = +3а, De = + а + (-2а) = - а,
где а – вклад одного углеродного центра, помеченного знаком + или -
Сравнивая экспериментальные данные и оценку эффектов в соответствии с правилом октанов, находим, что экспериментальные и расчетные данные совпадают между собой в пределах ошибок эксперимента. Это в свою очередь подтверждает предсказательные возможности правила октантов.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1044; Нарушение авторских прав?; Мы поможем в написании вашей работы!

 о
о