
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 8. Электролиз расплавов щелочей (гидроксида натрия)
|
|
|
|
Электролиз расплавов
Электролизом расплавов получают металлы, имеющие сильно отрицательные электродные потенциалы, и некоторые их сплавы.
При высокой температуре электролит и продукты электролиза могут вступать во взаимодействие друг с другом, с воздухом, а также с материалами электродов и электролизера. В результате этого простая, в принципе, схема электролиза (например, электролиз MgCl2 при получении магния) усложняется.
Электролитом обычно служат не индивидуальные расплавленные соединения, а их смеси. Важнейшим преимуществом смесей является их относительная легкоплавкость, позволяющая проводить электролиз при более низкой температуре.
В настоящее время электролизом расплавов получают алюминий, магний, натрий, литий, бериллий и кальций. Для получения калия, бария, рубидия и цезия электролиз расплавов практически не применяется из-за высокой химической активности этих металлов и большой их растворимости в расплавленных солях. В последние годы электролизом расплавленных сред получают некоторые тугоплавкие металлы.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации соли | NaОН Na+ +ОН- Na+ +ОН-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | На катоде в расплаве восстанавливаются ионы натрия. На аноде в расплаве окисляются гидроксид-ионы. |
| 3. | составить схемы процессов восстановления и окисления | К-: Na+ + 1 = Na0
А+: 4ОН- - 4 = Na0
А+: 4ОН- - 4 = О2 = О2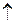 + 2Н2О + 2Н2О
|
| 4. | составить уравнение электролиза водного раствора соли | 4NaОН 4Na0+ 2Н2О + О2 4Na0+ 2Н2О + О2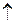
|
пример 9. Схема электролиза расплава хлорида меди (II).
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации расплава соли | CuCl2 Cu2+ + 2Cl- Cu2+ + 2Cl-
|
| 2. | выбрать ионы, которые будут разряжаться на электродах (согласно изложенным выше правилам) | Ионы меди в расплаве восстанавливаются. На аноде в расплаве ионы хлора окисляются |
| 3. | составить схемы процессов восстановления и окисления | К-: Cu2+ + 2 = Cu0
А+: 2Cl- - 2 = Cu0
А+: 2Cl- - 2 = Cl20 = Cl20
|
| 4. | составить уравнение электролиза расплава соли | CuCl2 Cu0 + Cl20 Cu0 + Cl20
|
пример 10. сх ема электролиза расплава сульфата натрия.
| Последовательность действий | Выполнение действий | |
| 1. | составить уравнение диссоциации расплава соли | Na2SO4 2Na+ + SO42- 2Na+ + SO42-
|
| 2. | составить схемы процессов восстановления и окисления | К-: Na+ + 1 = Na0
А+: 2 = Na0
А+: 2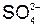 = = + 2 + 2  + + 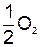 , ,
|
| 3. | составить уравнение электролиза расплава соли | 2Na2SO4 4Na +2 4Na +2 + + 
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1692; Нарушение авторских прав?; Мы поможем в написании вашей работы!