
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Активность и коэффициент активности электролитов
|
|
|
|
Растворы сильных электролитов характеризуются активностью.
Активность равна произведению концентрации на коэффициент активности.
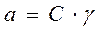 [моль/л]
[моль/л]
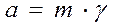 [моль/кг]
[моль/кг]
С, m – концентрации раствора; γ – коэффициент активности, который показывает насколько концентрация реального раствора отличается от концентрации идеального раствора вследствие взаимодействия между ионами в растворе. Тогда, активность показывает концентрацию раствора электролита с учетом взаимодействия между ионами. Для слабых электролитов γ = 1, поэтому а = С.
Величину а электролита можно определить экспериментально методом криоскопии, методом электродвижущей силы.
Величину а сильного электролита можно также рассчитать используя метод активностей, который основан на том, что свойства реальных растворов электролитов описываются уравнениями химических потенциалов, где вместо С используется а. Рассмотрим метод активностей.
Пусть дан сильный электролит Mv+ Av-, который полностью диссоциирует на ионы:
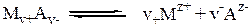
где v+, v-, z+, z- - стехиометрические коэффициенты и заряды ионов.
Поскольку раствор электролита в целом электронейтрален, то к нему применимо условие электронейтральности: химический потенциал электролита (μ) равен сумме потенциалов ионов, умноженных на их стехиометрические коэффициенты:
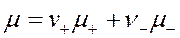 (условие электронейтральности)
(условие электронейтральности)
где 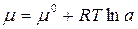 ;
;
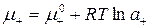 ;
;
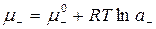 ;
;
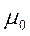 при Т=298, Р=1 атм.
при Т=298, Р=1 атм.
Подставим полученные значения в условие электронейтральности:
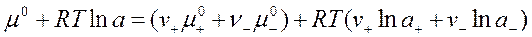 (1)
(1)
Стандартный химический потенциал электролита μ0 связан с 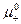 и
и 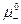 соотношением аналогичным условию электронейтральности:
соотношением аналогичным условию электронейтральности: 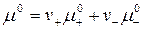 . Подставим данное выражение в уравнение (1):
. Подставим данное выражение в уравнение (1):
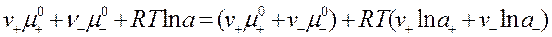
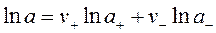
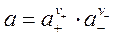 (2)
(2)
Однако по этой формуле невозможно рассчитать величину а, так как активности отдельных ионов не определяются экспериментально.
Поэтому вводится другое понятие – средняя ионная активность а± - это среднее геометрическое из активностей катиона а+ и аниона а- электролита:
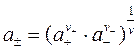 ; где
; где 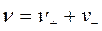 .
.
Подставим а± в уравнение для а (уравнение 2):
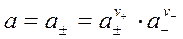
Видно, что а электролита равна а±, взятой в степени равной общему стехиометрическому коэффициенту 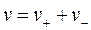 , тогда найдем значение а±:
, тогда найдем значение а±:
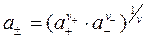 (3)
(3)
где 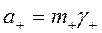 и
и 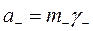 ;
;
γ+, γ- - коэффициенты активности катиона и аниона;
m+, m- - моляльности катиона и аниона, моль/кг (моляльность – это отношение количества растворенного вещества в молях к массе растворителя в кг).
Подставим величины а+ и а- в уравнение для а± (уравнение 3):
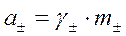
Величина m± - это средняя ионная моляльность, равная среднему геометрическому из моляльностей катиона и аниона:
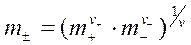
где 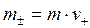 и
и 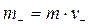 ;
;
Подставим m+ и m- в уравнение для m±:
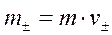
где 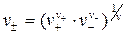 - средний ионный стехиометрический коэффициент, равный среднему геометрическому из стехиометрических коэффициентов катиона и аниона.
- средний ионный стехиометрический коэффициент, равный среднему геометрическому из стехиометрических коэффициентов катиона и аниона.
Рассмотрим как взаимосвязаны m± и m для соединений разных валентных типов:
1-1 – валентные соединение (NaCI):
 ;
; 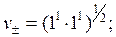
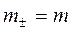 ;
;
2-2 – валентные соединения (MgSO4);
 ;
; 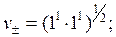
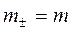 ;
;
3-2 – валентные соединения 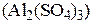 :
:
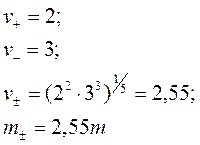
Величина γ± - это средний ионный коэффициент активности, равный среднему геометрическому из коэффициентов активности катиона и аниона
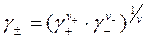
В зависимости от способа выражения концентрации электролита существуют следующие виды коэффициента активности:
1) рациональный коэффициент активности:
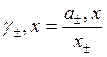
где x± - мольная доля ионов.
2) средний моляльный коэффициент активности (или практический):
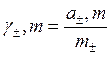
m± - моляльность ионов;
3) средний молярный коэффициент активности:
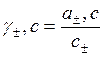
С± - молярность ионов.
Средний коэффициент активности γ± можно определить экспериментально методом криоскопии или методом электродвижущей силы.
Величина γ± зависит от концентрации электролита. Зависимость имеет следующий вид (рис. 1):
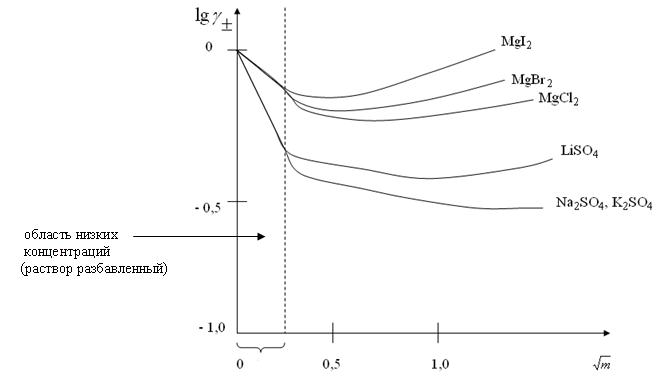
Рис. 1. Средние коэффициенты активности 2–1 и 1–2-валентных электролитов при 25 0С
В области низких концентраций зависимость имеет линейный характер и величина γ± одинакова для солей одного валентного типа (т. к. тангенс угла наклона прямой одинаков для солей одного валентного типа).
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 12182; Нарушение авторских прав?; Мы поможем в написании вашей работы!