
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения теории Дебая-Гюккеля
|
|
|
|
Ионная сила раствора. Правило ионной силы (или закон ионной силы Льюиса и Рендалла).
Концентрацию растворов сильных электролитов можно характеризовать не только активностью а, но и ионной силой. Активность а характеризует концентрацию одного электролита в растворе, а через ионную силу можно выражать концентрацию как одного, так и нескольких электролитов. Таким образом, ионная сила показывает суммарную концентрацию всех электролитов в растворе с учетом взаимодействия между ионами.
Ионная сила раствора (I, размерность концентрации) – это полусумма произведений концентраций всех ионов в растворе на квадрат их заряда.
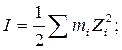
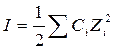
где  - моляльность i-го иона; m – моляльность электролита; Zi – заряд i-го иона.
- моляльность i-го иона; m – моляльность электролита; Zi – заряд i-го иона.
Пример: раствор содержит 0,001 моль H2SO4 и 0,002 моль MgSO4 на 1000 грамм H2O. Какова ионная сила раствора?
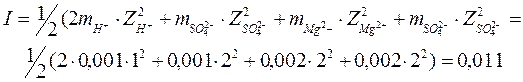
От ионной силы раствора зависит γ±. Эта зависимость выражается правилом ионной силы (или закон ионной силы Льюиса и Рендалла):
коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора.
Это эмпирическое правило строго выполняется при концентрациях до 0,01 моль/кг и приближенно до 0,1 моль/кг (рис. 2).
В области концентраций 0,01 – 0,1 моль/кг существуют следующие закономерности:
1. зависимость 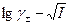 линейная, поэтому γ± зависит только от I и не зависит от природы иона;
линейная, поэтому γ± зависит только от I и не зависит от природы иона;
2. для соединений одного валентного типа γ± одинаков (т. к. в области низких концентраций тангенс угла наклона прямой одинаков).

Рис. 2. Средние коэффициенты активности HCl и HBr в растворах галогенидов щелочных металлов при 25 0С.
В 1923 г. Дебай и Гюккель разработали электростатическую теорию растворов сильных электролитов (или теория сильных электролитов Дебая-Хюккеля).
Теория сильных электролитов Дебая-Хюккеля справедлива только для разбавленных растворов сильных электролитов.
Основные положения теории:
1. собственными размерами ионов можно пренебречь по сравнению с расстоянием между ними, поскольку растворы разбавленные.
2. учитываются только кулоновские взаимодействия между ионами и не учитываются другие виды взаимодействия (ион-дипольное, образование ассоциатов за счет водородной связи и т. д.)
3. электростатическое взаимодействие между ионами рассматривается как взаимодействие между центральным ионом и его ионной атмосферой.
4. вследствие кулоновского взаимодействия ионы в растворе расположены упорядочено, а растворы являются неидеальными.
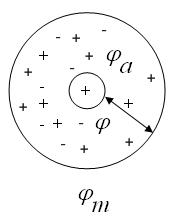 Ионная атмосфера – представляет собой некоторое усредненное распределение ионов, возникающее вокруг каждого иона (называемого центральным) под влиянием двух факторов – электростатических взаимодействий, которые стараются упорядочить ионы, и теплового движения, стремящегося расположить их хаотически.
Ионная атмосфера – представляет собой некоторое усредненное распределение ионов, возникающее вокруг каждого иона (называемого центральным) под влиянием двух факторов – электростатических взаимодействий, которые стараются упорядочить ионы, и теплового движения, стремящегося расположить их хаотически.
Ионная атмосфера состоит из ионов противоположных по знаку центральному иону.
В отсутствие внешнего электрического поля ионная атмосфера имеет шаровую симметрию, а ее заряд равен по величине и противоположен по знаку заряду центрального иона. Плотность ионной атмосферы уменьшается по мере удаления от центрального иона.
Ионную атмосферу можно характеризовать следующими параметрами:
1) потенциал ионной атмосферы:
потенциал электрического поля φm вокруг какого-либо иона состоит из потенциала центрального иона (φ) и потенциала ионной атмосферы (φа):

Поскольку раствор электролита электронейтрален, то потенциал электрического поля вокруг иона равен 0:

Тогда, потенциал ионной атмосферы равен потенциалу центрального иона с противоположным знаком:

2) эффективный радиус ионной атмосферы (r):
это расстояние вдоль прямой от центрального иона, на котором плотность ионной атмосферы уменьшается приблизительно в е раз.
Чем больше величина r, тем медленнее изменяется плотность ионной атмосферы.
Согласно теории Дебая-Хюккеля можно вычислить величину среднего коэффициента активности γ± сильного электролита по уравнениям трех приближений теории Дебая-Гюккеля.
I приближение теории Дебая-Гюккеля(или предельный закон Дебая-Гюккеля) для среднего коэффициента активности γ±:
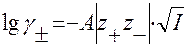
I – ионная сила раствора; 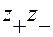 - заряды катиона и аниона; А – константа, зависящая от Т, плотности ρ и диэлектрической проницаемости
- заряды катиона и аниона; А – константа, зависящая от Т, плотности ρ и диэлектрической проницаемости 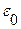 растворителя, раствора
растворителя, раствора 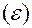 .
.
Для вычисления коэффициентов активности отдельных ионов используется уравнение:
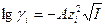

Для водных растворов при 25 0С А=0,510 моль-1/2∙кг-1.
I приближение теории Дебая-Гюккеля справедливо для сильно разбавленных растворов с ионной силой до 0,01 моль/кг. При этом размером ионов пренебрегают (считают их материальными точками). Согласно уравнению І приближения теории Дебая-Гюккеля зависимость 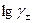 от
от 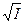 имеет линейный характер, что соответствует начальным участкам кривых (рис.3).
имеет линейный характер, что соответствует начальным участкам кривых (рис.3).
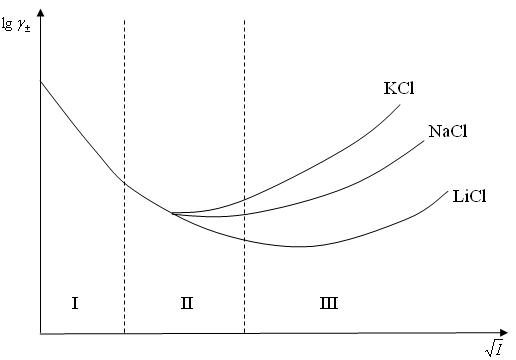
Рис. 3. Приближения теории Дебая-Хюккеля
Выводы из I приближения теории Дебая-Гюккеля:
1. для сильных разбавленных растворов электролитов 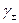 одинаков для всех соединений в пределах одного валентного типа
одинаков для всех соединений в пределах одного валентного типа 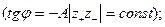
2. в области низких концентраций (когда I раствора мала) 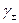 линейно зависит только от I;
линейно зависит только от I;
3. предельный закон Дебая-Гюккеля дает теоретическое обоснование эмпирическому правилу ионной силы.
II Приближение теории Дебая-Гюккеля: справедливо для I раствора до 0,1 моль/кг. При этом учитываются размеры ионов. Уравнение II приближения Дебая-Гюккеля описывает зависимость (рис. 3), когда с ростом концентрации (т. е. I раствора) величина 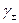 уменьшается, и имеет следующий вид:
уменьшается, и имеет следующий вид:

где В – эмпирический параметр, который связан с эффективным диаметром ионов в растворе. Эффективным диаметром называется такой диаметр иона, если бы он был в кристаллической решетке.
Приближенной формой II приближения теории Дебая-Гюккеля является уравнение Гюнтельберга:

где В = 1 для всех электролитов. Это уравнение удобно тем, что не содержит эмпирических параметров и удовлетворительно описывает поведение электролитов до концентрации 0,1 моль/кг.
III Приближение теории Дебая-Гюккеля: справедливо для растворов электролитов с ионной силой до 1 моль/кг; учитывает сольватацию иона молекулами растворителя. Уравнение III приближения описывает зависимость (рис. 3), когда с ростом 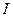 увеличивается
увеличивается 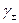 , и имеет следующий вид:
, и имеет следующий вид:

где С – эмпирический параметр, который учитывает поляризацию молекул растворителя вокруг иона растворенного вещества.
Уравнение III приближения теории Дебая-Гюккеля было усовершенствовано путем введения дополнительного слагаемого:
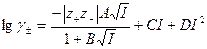
где D – эмпирический параметр. Это уравнение Харнеда и Оуэна, которое позволяет описывать поведение многих электролитов до 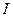 порядка нескольких моль/кг (до 5 моль/кг).
порядка нескольких моль/кг (до 5 моль/кг).
В области больших концентраций (более 1–5моль/кг) поведение растворов сильных электролитов невозможно точно описать, в частности зависимость 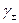 от
от 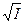 . До сих пор на этот счет не существует строгой теории.
. До сих пор на этот счет не существует строгой теории.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 39209; Нарушение авторских прав?; Мы поможем в написании вашей работы!