
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Э л е к т р о х и м и я
Электролиты - вещества, которые в растворе или в расплаве распадаются на ионы – электрически заряженные частицы, способные к самостоятельному существованию в этих средах. Электролиты – проводники второго рода.
Биожидкости организма, внутри- и межклеточные жидкости содержат большие количества электролитов, играющих важную роль в функционирование живых клеток. Биохимические процессы в организме протекают при непосредственном участии электролитов: они ответственны за проведение нервных импульсов, концентрацией электролитов во многом определяется проницаемость биологических мембран. Анализ содержания электролитов в тканях и жидкостях организма позволяет проводить диагностику патологических состояний, определить константы биохимических процессов.
Процесс распада растворенного вещества на ионы называется электролитической диссоциацией. Диссоциация наблюдается в полярных растворителях и зависит от e - диэлектрической проницаемости среды(чем больше e, тем диссоциация лучше).
Чаще всего примером электролитической диссоциации могут служить водные растворы. Схематически распад молекулы на ионы можно представить следующим образом:
1) 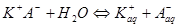 (NaCl) для ионного типа решетки
(NaCl) для ионного типа решетки
2) 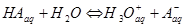 (HCl) для неионного типа решетки с ковалентной связью.
(HCl) для неионного типа решетки с ковалентной связью.
Электропроводность растворов электролитов.
Электропроводность – способность веществ проводить электрический ток. Это – абстрактное понятие. А вот обратная величина, то есть неспособность раствора проводить электрический ток – сопротивление, можно измерить:
 [ См ] или [1/Ом ],
[ См ] или [1/Ом ],
где W – электропроводность, а R – сопротивление.
Удельная электропроводность k (каппа) – характеризует электропроводность раствора электролита объемом 1 м3, заключенного между двумя электродами, которые расположены на расстоянии (l) 1 м и имеет площадь поперечного сечения (S) 1 м2.
 , (3.1)
, (3.1)
где r - удельное сопротивление: 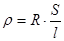 [Ом ∙ м],
[Ом ∙ м],
Удельная электропроводность зависит от концентрации раствора, температуры, природы вещества:
1)  k = k (С)
k = k (С)
Рис.1 Зависимость удельной электропроводности
растворов от концентрации раствора
для сильного (кривая 1) и слабого (кривая 2) электролитов.
2) Увеличение температуры на 1 0С, увеличивает электропроводность на 2-2.5 %.
Но в 1 м3 раствора разные электролиты содержат различное количество растворенного вещества, поэтому сложно сравнивать их удельные электропроводности. Для этого используется l – мольная электропроводность – электропроводность 1 моля раствора электролита, заключенного между двумя пластинами, расположенными на расстоянии 1 м.
 . (3.2.1)
. (3.2.1)
Если привести к 1 л объема, то:
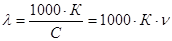 , (3.2.2)
, (3.2.2)
где n - разведение (разбавление), объем раствора, содержащий 1 моль вещества.
 а б
а б
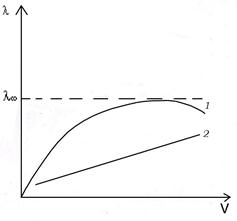
Рис. 2 Зависимость мольной электропроводности от концентрации (а) раствора и от разведения (б) для слабого (кривая 1) и сильного (кривая 2) электролитов.
Основные положения теории Аррениуса (теория слабых электролитов).
1. Диссоциация молекул электролитов происходит уже в процессе растворения, когда диполи воды гидратируют молекулу растворенного вещества, что приводит к ее диссоциации за счет поляризации связи и превращения ее в ионную. Ионы существуют в растворе независимо от того, наложено на него или нет электрическое поле.
2. Растворы электролитов подчиняются законам разбавленных растворов. Растворенное вещество самопроизвольно распространяется в объеме растворителя подобно тому, как газ распространяется в пустоту (но характер их различен). Важно, что для разбавленных растворов электролитов закон действующих масс применим в том же виде, что и для идеальных газов.
3. Динамический характер диссоциации – в растворе непрерывно происходят многократные акты диссоциации молекул на ионы и соединения ионов в молекулы. Электролитическая диссоциация – равновесный обратимый процесс. Количественно характеризуется степенью электролитической диссоциации (a) и константой диссоциации (Кд), которые определяются законом действующих масс. Степень диссоциации зависит от природ растворителя и электролита. По величине степени диссоциации все электролиты делятся на слабые и сильные: если a < 0.03, то электролит считается слабым, если a > 0.3, то сильным. Степень диссоциации зависит от концентрации электролита. Если a = 1, то в растворе присутствуют только одни ионы.
a = a (С)

Рис. 3 Зависимость степени диссоциации от концентрации для
сильного (кривая 1) и слабого (кривая 2) электролитов.
Способность вещества диссоциировать в растворе учитывает и i – изотонический коэффициент Вант-Гоффа, характеризующий эффективное число частиц в растворе электролита, которое оказывает влияние на процессы в растворах электролитов.
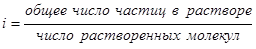 ,
,
который следующим образом связан со степенью диссоциации:
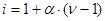 ,
,
где n – число ионов на которых диссоциирует электролит. Для идеальных растворов i > 1.
Для электролитов коллегативные свойства учитывают наличие диссоциации:
Пример: 1) Осмотическое давление для электролитов: 
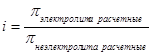 ,
,
2) закон Рауля для электролитов:
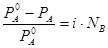 .
.
4. В случае слабых электролитов, подвижности ионов не зависят от концентрации электролита, а l и l¥ (мольная электропроводность при бесконечном разведении) различаются потому, что общее число ионов в растворе зависит от степени диссоциации:
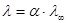 ,
,
 , (3.3)
, (3.3)
Пример: Рассмотрим диссоциацию типичного слабого электролита:
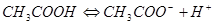
По закону действующих масс:
 ,
,
где 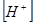 ,
, 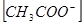 равновесная концентрация ионов
равновесная концентрация ионов  и
и  соответственно.
соответственно.
Пусть C0 – концентрация кислоты до диссоциации,
тогда
 ,
,
 .
.
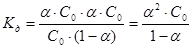 - Закон разбавления Оствальда. (3.4)
- Закон разбавления Оствальда. (3.4)
Для очень слабого электролита a << 1.Поэтому, когда a находится в знаменателе, ей можно пренебречь.
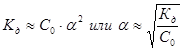
Сильные Электролиты фактически нацело диссоциируют на ионы, поэтому закону действующих масс и закону разбавления Оствальда не подчиняются. Следовательно, Кд зависит от концентрации при заданной температуре и не является постоянной. Применимость закона Оствальда является признаком слабого электролита.
Сильные электролиты. Теория Дебая-Хюккеля.
1. Ионы считаются лишенными размеров.
2. Теория учитывает лишь кулоновское взаимодействие между частицами.
3. Учитывают лишь электростатическое взаимодействие между центрами ионов и их ионной атмосферой.
Релаксационный эффект: Каждый ион окружен ионами противоположенного знака, которые образуют ионную атмосферу. Под действием электрического поля центральный ион выходит из ионной атмосферы, таким образом, разрушает ее и образует новую. возникает ее деформация, и возникает торможение иона за счет неравномерности ионной атмосферы. Время, необходимое для образования и разрушения ионной атмосферы называется временем релаксации.
Электрофоретический эффект: торможение ионной атмосферы под действием электрического поля.
Таким образом, сильные и слабые электролиты отличаются не только степенью диссоциации, но и всем механизмом диссоциации.
Подвижность ионов и числа переноса.
Электропроводность зависит от подвижности ионов. Молярную электропроводность раствора электролита можно выразить следующим образом:
 , где
, где
l+ и l- - мольная проводимость ионов или подвижность ионов, связанная с абсолютной скоростью движения ионов  , которая зависит от размеров ионов и окружающей ионы сольватной оболочки, от валентности (для многовалентных ионов).
, которая зависит от размеров ионов и окружающей ионы сольватной оболочки, от валентности (для многовалентных ионов).
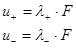 (3.5)
(3.5)
Подвижность имеет размерность мольной электропроводности 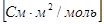 .
.
Пример:
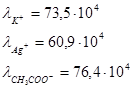
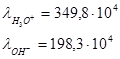
Закон Кольрауша (закон независимости движения ионов при бесконечном разбавлении).
 (3.6)
(3.6)
При бесконечном разбавлении мольная электропроводимость равна сумме подвижностей ионов (ионных электропроводностей). Закон Кольрауша позволяет рассчитать предельную молярную электропроводность раствора электролита l¥ по известным значениям ионных подвижностей.

Пример:
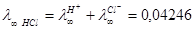
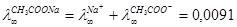
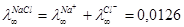

Так как скорость ионов различна, следовательно, различная доля вещества, переносимая ими.
Число переноса – отношение абсолютной скорости движения катиона или аниона (u+ или u-) и суммарной скорости ионов:
 (3.7)
(3.7)
или
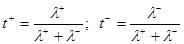
или
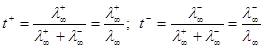 ,
,
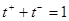 (для слабого и для сильного электролита).
(для слабого и для сильного электролита).
|
|
Дата добавления: 2014-01-06; Просмотров: 478; Нарушение авторских прав?; Мы поможем в написании вашей работы!