
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 11-12
|
|
|
|
Кондуктометрические и потенциометрические
методы исследования
План:
Кондуктометрия
Метод кондуктометрического титрования
Высокочастотное титрование
Потенциометрический анализ (ПА)
1. Кондуктометрические методы (КМ) основаны на зависимости между электрической проводимостью раствора и концентрацией ионов в этом растворе.
Электрической проводимостью называют способность вещества проводить электрический ток под действием электрического поля. Ее единицей измерения является сименс (См)
Перенос электричества в проводниках I рода - металлах – осуществляется движением электронов по проводнику в направлении от отрицательного полюса источника тока к положительному. В проводниках II рода – растворах электролитов – перенос электричества осуществляется движением ионов. Анионы движутся к аноду, катионы – к катоду.
Движение ионов в растворе тормозят молекулы растворителя и окружающие противоположно заряженные ионы. Это релаксационный и электрофоретические эффекты. Электрпроводность раствора зависит от числа, скорости мигрирующих ионов, количества переносимых ими зарядов, температуры и состава растворителя.
Проводимость бывает удельная (χ)и молярная (λ).
Удельная электрическая проводимость χ (см/м) – это проводимость 1м3 раствора, находящегося между электродами площадью 1м2 каждый, расстояние между которыми равно 1м:
(11.1
где α – степень диссоциации электролита;
С – концентрация электролита;
F – постоянная Фарадея,
u+,u-, z+, z- – скорости движения (м/с) и заряды катионов и анионов соответственно при напряженности электрического поля 1 В/см.
Молярная электропроводимость (см·м2/моль) – это электропроводимость раствора, содержащего 1 моль электролита, измеренная при расстоянии между электродами 1м.
λ = χ С (11.2)
При кондуктометрии измеряемый аналитический сигнал – это электропроводность раствора. По мере повышения концентрации растворенного электролита увеличивается количество ионов -переносчиков заряда, т.е. растет удельная электропроводимость (χ).
Но после достижения определенного максимума значение начинает падать, т.к. в сильных электролитах усиливается релаксационный и электрофоретический эффекты, а в слабых – уменьшается степень диссоциации. Электропроводимость бесконечно разбавленного раствора λ∞ зависит от подвижности ионов:
(11.3)
Электропроводимость раствора уменьшается с ростом концентрации С, для сильного І-валентного электролита. Ее рассчитывают по формуле:
(11.4)
где А и В – величины, которые зависят от температуры, вязкости раствора и диэлектрической проводимости растворителя.
Метод применяют в прямой кондуктометрии или в кондуктометрическом титровании.
Мостик питается переменным током от генератора «2». Постоянный ток нежелателен, т.к. вызывает электролиз раствора. Для питания моста обычно используется ток с частотой (Н) 1000Гц. В качестве эталонного сопротивления Rm включают магазины сопротивлений типа Р-517 М, Р-58 и т.д. 1-это нуль-инструмент (G).
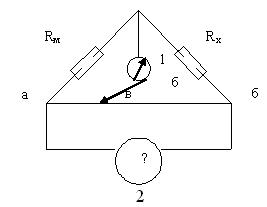
Рис. 11.1 Схема мостика Уитсона
Конструкции таких ячеек различны. В прямой кондуктометрии применяют ячейки с жестко закрепленными электродами. При кондуктометрическом титровании применяют наружные электроды, позволяющие проводить титрование в любых сосудах.
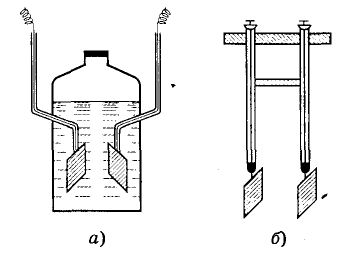
Рис. 11. 2. Ячейки для кондуктометрического анализа:
а –жестко закрепленные электроды; б–съемные электроды
Истинная электропроводимость раствора χ пропорциональна экспериментально измеренной величине χ':
χ=kχ', (11.5)
где k – константа сосуда
k = L/S (11.6)
L – расстояние между электродами,
S – площадь электродов.
В агрохимии кондуктометрические измерения применяют для определения влажности, содержания солей в воде и почве, автоконтроля уровня грунтовых вод при поливе, изучение динамики поступления питательных веществ к корневой системе растений. Электропроводимость растворов можно измерять с высокой точностью только в разбавленных растворах. В области разбавленных и умеренно концентрированных растворов электропроводимость растет с увеличением концентрации электролита. В связи с относительно близкими значениями подвижностей ионов кондуктометрические измерения дают сведения, главным образом, лишь об общей концентрации ионов в растворе.
2. Поэтому предпочтительнее использовать метод кондуктометрического титрования. При кондуктометрическом титровании измеряют электропроводимость раствора после добавления небольших определенных порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах χ- V титранта.
В методе хронокондуктометрического титрования титрант подается в анализируемый раствор непрерывно или небольшими одинаковыми дозами через строго определенные промежутки времени.
Одновременно на диаграммной ленте самописца производится соответственно непрерывная или точечная запись кондутометрической кривой в координатах показание прибора – время. Показания прибора пропорциональны электропроводимости. Концентрация вещества рассчитываются по времени затраченному на титрование. Так как скорость подачи рабочего раствора постоянна и точно известна, время титрования прямо пропорционально объему реактива, израсходованному на титрование.
3. При высокочастотном титровании (ВТ) ячейка с анализируемым раствором помещается или между пластинками конденсатора, или внутри индукционной катушки.
В ячейках ВТ электроды не соприкасаются с раствором, что является одним из существенных достоинств метода.
В случае индуктивного методы ячейка с раствором включается в цепь колебательного контура. Изменение состава раствора при титровании в такой ячейке вызывает изменение индуктивности, что фиксируется микроамперметром.
В конденсаторных ячейках при титровании раствора из-за изменения диэлектрической проницаемости происходит сдвиг рабочей частоты генератора, что устанавливается с помощью измерительного конденсатора. При построении кривой титрования показания прибора откладывают как функцию объема добавленного титранта.
4. Потенциометрический анализ (ПА) – метод определения концентрации ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в раствор.
В агрохимии потенциометрию используют для определения активной концентрации элементов в тканях растений и в почве. Потенциомтер развивается по нескольким направлениям:
Потенциометри
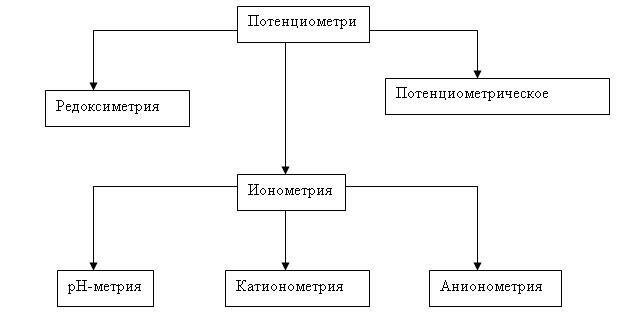
Потенциометрия позволяет вести измерения в мутных и окрашенных средах, пастах и даже живых биологических объектах.
Как известно, вещества в растворах диссоциируют на ионы. Эти ионы и неразложившиеся молекулы в растворе взаимодействуют друг с другом и в результате получается как будто концентрация их меньше, чем в действительности. Явление кажущегося снижения коцентрации раствора подтолкнуло Г.Льюиса ввести понятие активности
, (12.1)
где а – активность; С-концентрация; γ - коэффициент активности,
активность имеет размерность концентрации.
При с → 0, γ→ 1.
П. Дебай и Э. Хюккель предположили, что в растворах сильных электролитов каждый ион окружен ионным облаком. Численная характеристика ионного облака – это ионная сила раствора:
(12.2)
Где Zi и Сi – заряд и концентрация i-того иона.
Коэффициент активности γ зависит только от концентрации электролита. Тип электролита обозначают двумя цифрами:
KCl (1:1); BaCL2 (1:2); Fe (NO3)3 (1:3).
Для водных растворов электролитов состава 1:1 справедлив закон Дебая-Хюккеля
, (12.3)
где А – константа, зависящая от температуры и диэлектрической проницаемости растворителя.
Потенциометрические методы основаны на измерении электродвижущей силы (ЭДС)
Е = Е1 – Е2, (12.4)
где Е – ЭДС; Е1 и Е2 – потенциалы электродов исследуемой цепи. ЭДС связан с активностью и концентрацией веществ уравнением Нернста:
, (12.5)
где Е0 – стандартный потенциал редокс-системы;
R = 8,312 дж/мольК, Т-абсолютная температура раствора, К;
Е = 96500 кл/моль; и – число электронов;
αох, αred – активности окисленной и восстановленной форм редокс-системы;
[ox],[red] – их молярная концентрация;
- коэффициенты активности.
Подставляя данные, можно получить:
(12.6)
Уравнение (12.6) можно переписать так:
(12.7
где
Величину называют формальным потенциалом, который зависит от ионной силы раствора.
Методы ПА делятся на прямую потенциометрию (ионометрию) и потенциометрическое титрование. Методы прямой П основаны на прямом применении уравнения Нернста для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу соответствующего электрода.
Наибольшее распространение среди прямых потенциометрических методов получил метод определения рН.
Электроды, на межфазных границах которых протекают ионообменные реакции, называют мембранными, или ионообменными, или ионоселективными.
Ионослективный электрод (ИСЭ) представляет собой гальванический полуэлемент, состоящий из ионослективной мембраны, внутреннего раствора и внутреннего электрода сравнения. Внутренний раствор и внутренний электрод сравнения при измерении ЭДС ячейки остаются постоянными.
Селективность электродов, т.е. возможность определения того или иного иона в присутствии мешающих ионов, колеблется в широких пределах.
Важная характеристика ИСЭ – время его отклика, т.е. время, необходимое для достижения постоянного значения потенциала электрода при перемещении его из одного раствора в другой, отличающийся от концентрации определяемого иона.
Принцип действия потенциометра самостоятельно.
Потенциометрическое титрование (ПТ) основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода.
Для ПТ собирают цепь из индикаторного электрода в анализируемом растворе и электрода сравнения. В качестве электродов сравнения чаще всего испытывают электроды ІІ рода – каломельный и хлоро-серебряный.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 835; Нарушение авторских прав?; Мы поможем в написании вашей работы!