
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 13. Электрохимические и полярографические методы
|
|
|
|
Электрохимические и полярографические методы
План:
Теория методов
Электрогравиметрический анализ (ЭГА)
Кулонометрия
Полярография
Электрохимия изучает взаимосвязь между электрической энергией и химическими реакциями. При этом методе используют электрохимическую ячейку, которая состоит из электродов и электролитов, контактирующих между собой.
Э-Х методы делятся на 2 группы:
Первая группа – полярография и полярографическое титрование (гальванические элементы). К второй группе относят методы с использованием электролитической ячейки (электрогравиметрия, кулонометрия, вольтамперометрия).
2. В электрогравиметрическом анализе анализируемое вещество количественно выделяют из раствора электролизом и по массе выделившегося металла или его оксида рассчитывают содержание определяемого элемента в пробе.
ЭГА можно рассматривать как один из видов гравиметрического анализа, в котором в качестве осадителя выступают элекроны. Важнейшими требованиями к форме осаждения являются ее малая растворимость и чистота. ЭГА применяют для концентрирования макро- и микроэлементов из природных и промышленных обьектов, для разделения, для проведения внутреннего электролиза. Важным достоинством метода внутреннего электролиза является возможность проведения тонких химичесих разделений, так как на платиновом катоде выделяются металлы более благородные, чем металл анода.
3. В кулонометрическом методе определяют количество электричества, которое расходуется в ходе электрохимической реакции.
Виды кулонометрии: прямая кулонометрия (ПК) и кулонометрическое титрование (КТ).
ПК осуществляют при постоянном потенциале или силе тока. При этом определяемое вещество непосредственно окисляется или восстанавливается на электроде.
КТ, при котором точка эквивалентности соответствует моменту, когда сила тока электролиза достигает величины «фонового» тока. При КТ не прибавляют стандартный раствор титранта.
Согласно закону Фарадея
m = (13.1
количество вещества, превращаемого при электролизе, прямо пропорционально силе тока и времени. Поэтому в КТ вместо обьема и массы обычно измеряют время и силу тока.
4. Полярографический метод (ПМ) относится к группе методов вольтамперометрии (ВА). ВА включает классическую полярографию, вольтамперметрическое титрование и т.д.
Во всех этих методах исследуют зависимость вещества характеристик от электрохимического процесса окисления или восстановления вещества, находящихся в растворе. ПМ был предложен чешским ученым Я. Гейровским в 1922г. Название метода связано с процессами поляризации, возникающими при пропускании электрического тока через растворы элетролитов.
В классичеком ПМ обычно применяют ртутный капающий электрод. Это исходит из следующих соображений.
1. На катоде плотность тока по сравнению с катодом большого размера очень велика, что обуславливает характерную для полярографии зависимость силы тока от приложенного внешнего напряжения.
2. На ртутной капле ионы Н+ восстанавливаются с большим перенапряжением, что позволяет полярографировать ионы металла, находящиеся в ряду напряжений влево от водорода,вплоть до ионов щелочно-земенльных и щелочных металлов.
3. Поверхность капающего электрода непрерывно обновляется, что обеспечивает высокую воспроизводимость полярографических кривых.
Количественный ПА. Испытуемый раствор помещают в электролизер и соединяют электроды с источником тока. При достаточном напряжении начинается электролитическое выделение данного металла.
При недостаточном напряжении ток практически не идет через электролит, т.е. электролиза нет. После достижения определенного напряжения сила тока увеличивается и кривая зависимости силы тока (і) от потенциала (Е) круто поднимается вверх. В результате электролиза концентрация восстанавливающихся ионов вблизи поверхности микрокатода уменьшается. При небольшой силе тока эта убыль ионов пополняется за счет диффузии ионов из других, более отдаленных от поверхности микрокатода частей раствора. Поэтому вначале при увеличении напряжения сила тока продолжает возрастать, и кривая поднимается. Однако по достижении некоторой силы тока выделение металла идет так быстро, что процесс диффузии не обеспечивает подхода к поверхности электрода достаточного количества ионов восстанавливающегося металла. Поэтому несмотря на дальнейшее увеличение напряжения, сила тока будет оставаться без изменения; кривая зависимости силы тока от приложенного напряжения образует характерный горизонтальный перегиб (рис 13.1а)
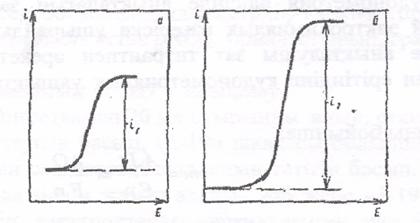
Рис. 13.1. Полярографичекая волна (вольтамперные кривые)
i1, i2 – предельные токи
Сила тока, соответствующая высоте i1 (высоте волны) называется предельным током. Но если увеличить концентрацию металла в 2 раза, то получим кривую на рис.13.1 б. Характер этой кривой совершенно аналогичен характеру кривой на рис.”a”. Но высота волны i2 в 2 раза больше чем высота волныi1.
Таким образом, при одних и тех же условиях предельный ток прямо пропорционален концентрации ионов, восстанавливающихся на катоде. Эта зависимость и является основой количественного ПА. Более подробно она описывается уравнением Ильковича, вывод которого можно найти в специальных руководствах по полярографии
inp = 605nD1/2m2/3t1/6C = КC, (13.2)
где n - количество электронов, участвующих в электрохимичеком восстановлении определяемого иона;
D – коэффициент диффузии определяемого иона, см2. сек-1;
m- количество ртути, вытекающей из капилляра за 1 сек, мг.сек-1;
t – период капания, сек;
с – концентрация восстанавливающихся ионов, ммоль/л;
I – сила тока, мка.
На практике концентрацию ионов можно определять методами калибровочного графика и добавок.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 601; Нарушение авторских прав?; Мы поможем в написании вашей работы!