
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стереоизомерия соединений с двумя центрами хиральности
|
|
|
|
Cl
Стереоизомерия соединений с одним центром хиральности
ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНОСТЬ КАК ПРИЧИНА ПОЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ СВОЙСТВ У ГИДРОКСИ- АМИНО- И КЕТОКИСЛОТ
ЛЕКЦИЯ 11
ПЛАН
11.1. Стереоизомерия соединений с одним центром хиральности
11.2. Стереоизомерия соединений с двумя центрами хиральности
11.3. Стереоизомерия соединений с двойной связью (π-диастереоизомерия)
11.4. Реакционная способность гетерофункциональных соединений
Атом углерода в sp3-гибридизации имеет тетраэдрическую кон-
фигурацию. Если из 4 заместителей, хотя бы 2 одинаковые, то для такой молекулы существует плоскость симметрии, если же все заместители различные, то симметрия исчезает. Это обстоятельство рождает новое явление хиральность - свойство молекулы соединения не совмещаться со своим зеркальным отображением.
Хиральность присуща миру материальных объектов - руки, левые и правые спирали.
Существует 2 типа соединений – соединения, которые не могут быть совмещены со своим зеркальным отражением называются хиральными.
Хиральная молекула 2-хлорбутана х
СН3 – СН – СН2 –СН3
׀
 |
Ахиральная молекула пропановой кислоты
СН3 - СН2 – СООН
 |
Термин хиральность (от древнегреческого "хир") рука ввел английский физик Кельвин в 1884 году для обозначения объектов, которые подобно правой и левой руке не совмещаются друг с другом.
Для установления хиральности молекулы используют построение моделей молекул и их зеркальных отражений с последующим их совмещением.
Простейший случай возникновения хиральности - наличие асимметрического атома углерода - т.е. такого атома, который связан с четырьмя различными атомами или группами, хотя это и не единственное достаточное условие появления хиральности.Характерное свойство хиральных соединений - способность вращать плоскость поляризации поляризованного света. Хиральные молекулы всегда оптически активны.
Геометрическое свойство молекул - хиральность лежит в основе деления конфигурационных и конформационных стереоизомеров на энантиомеры и диастереомеры.
Энантиомеры или оптические антиподы - это два хиральных стереоизомера, которые являются зеркальным изображением друг друга. Энантиомеры относятся друг к другу как предмет и несовместимое с ним зеркальное изображение. Основное условие возникновения энантиомеров - хиральность молекул. Энантиомеры - оптические изомеры, оптические антиподы, имеют одинаковые физические и химические свойства; температуры кипения, плавления, растворимость, показатели преломления, спектральные характеристики,
ИК- и УФ-спектры. Тем не менее они представляют собой различные соединения с характерными отличающимися свойствами.
1. Энантиомеры вращают плоскость поляризации поляризованного света на один и тот же угол вращения (α), но в противоположных направлениях. Энантиомер, отклоняющий плоскость поляризации поляризованного света влево (против часовой стрелки) называют левовращающим, ему приписывают знак (-), по часовой стрелке - правовращающим, ему приписывают знак (+).
2. Энантиомеры реагируют с другими хиральными соединениями с различной скоростью, что имеет большое значение для биохимических процессов, так как многие реагенты природного происхождения (ферменты) обычно вступают в реакции только с одним из энантиомеров.
3. При смешении равных количеств двух энантиомеров образуется оптически неактивная смесь (рацемат). Процесс превращения одного из энантиомеров в рацемическую форму называют рацемизацией, а перевод одного из энантиомеров в другой - инверсией.
Стереоизомеры, не являющиеся зеркальным изображением один другого и имеющие различные физические и химические свойства называются диастереомеры. В связи с тем, что диастереомеры имеют различные физические и химические свойства их можно отделить друг от друга с помощью обычных методов разделения органических соединений - кристаллизацией, перегонкой, адсорбцией и т. д.
Диастереомеры делятся на две группы - σ- и π-диастереоизомеры. Стереоизомеры, у которых хиральный центр связан с заместителями σ-связями называют σ-диастереоизомерами, а стереоизомеры, содержащие в качестве стерического центра π-cвязь - π-диастереоизомеры.
Стереоизомеры с одним центром хиральности. Молекулы, имеющие центры хиральности на плоскости принято изображать в виде проекционных формул Фишера: в точке пересечения горизонтальных и вертикальных линий подразумевается нахождение асимметрического атома углерода (без написания его символа), вверху располагают самую старшую характеристическую группу (она же имеет наименьший номер). Поскольку такими группами чаще всего бывает карбоксильная или альдегидная, то говорят, что вверху располагают наиболее окисленную группу. По горизонтали располагают неуглеродные заместители: атом водорода, гидроксильную группу, амино-группу и т.д.
Молекулы с одним центром хиральности существуют в виде двух энантиомеров, которые относятся друг к другу как предмет и несовместимое с ним зеркальное изображение.
Абсолютную конфигурацию, отражающую истинное расположение заместителей в пространстве впервые определили в 1951 году с помощью рентгеноструктурного анализа для (+)-винной кислотыю, однако это дорогостоящий метод.
В начале века из-за отсутствия высокоразрешающих физико-химических методов установить абсолютную конфигурацию было невозможно. Поэтому использовали путь определения относительной конфигурации, т.е. сравнения с известным стандартом. В качестве конфигурационного стандарта был избран глицериновый альдегид. Условно правовращающему глицериновому альдегиду была приписана конфигурация (I) и обозначена "D", а левовращающему энантиомеру - конфигурация (II), обозначенная "L". Эти обозначения стали первой системой стереохимической номенклатуры, которая отчасти используется и сейчас, например в области углеводов. В настоящее время действует R,S-номенклатура (R-ректус, правый; S-синистер, левый).
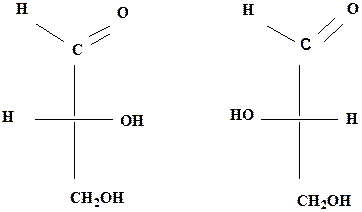 |
D-(+)-глицериновый L-(-)-глицериновый
альдегид (I) альдегид (II)
Соединениями с одним центром хиральности являются некоторые гидроксикислоты, участвующие в биохимических процессах: молочная кислота (продукт метаболизма глюкозы), яблочная кислота (участник цикла трикарбоновых кислот в организме).

D-молочная кислота L-молочная кислота
 |
D-яблочная кислота L-яблочная кислота
Отнесение хиральных соединений к стереохимическим рядам производится сравнением конфигурации с глицериновым альдегидом (в написании формул сравнивается расположение атомов у хирального центра).
Молекулы природных соединений часто содержат не один, а несколько центров хиральности. Например, в глюкозе 4 асимметрических атомов углерода, а представитель стероидов - холестерин содержит 8 асимметрических атомов углерода. Возрастание числа центров хиральности и приводит к появлению нового вида стереоизомерии - диастереомерии. Общее число стереоизомеров соответствует формуле 2n, где n-число асимметрических атомов.
Особый случай встречается в диастереомерии соединений, у которых центры хиральности содержат одинаковые заместители. Это приводит к тому, у молекулы может появиться плоскость симметрии (именно из-за одинаковых заместителей) и тогда такая молекула перестает быть хиральной; ее называют мезоформой. Мезоформы оптически неактивны. Примером служит мезовинная кислота.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 4680; Нарушение авторских прав?; Мы поможем в написании вашей работы!