
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кетоновые (ацетоновые) тела
|
|
|
|
ОН ОН
НООС-СН-СН-СООН винная кислота
│ │
Стереоизомеры винной кислоты:
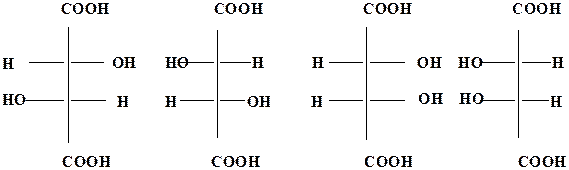
D-винная L-винная
кислота кислота мезовинная кислота
I II III
I и II - энантиомеры, I и III, II и III - диастереомеры.
В молекуле мезовинной кислоты появилась плоскость симметрии, поэтому она оптически неактивна.
К соединениям с двумя центрами хиральности относят также и некоторые аминокислоты, участвующие в биосинтезе белков. Примером такой аминокислоты служит треонин:
СН3 - СН - СН – СООН
׀ ׀
ОН NH2

D-алло треонин L-алло треонин D-треонин L-треонин
I II III IY
Энантиомеры - I и II; III и IY
Диастереомеры - I и III; I и IY; II и III; II и IY
Приставка алло используется для той пары энантиомеров, L-изомер которой не является структурным элементом белков.
11.3. π- диастереомеры
π-Диастереомеры относятся к конфигурационным стереоизомерам. Их название обусловлено содержанием в структуре органических соединений π-связи как стерического центра. Этот вид изомерии наблюдается у соединений с двойными связями (>C=C<, >C=N-, -N=N-),строение которых исключает свободное вращение вокруг двойной связи.
Диастереомеры, имея одинаковую последовательность связей атомов в молекуле и различаются между собой конфигурацией, т.е. пространственной ориентацией атомов или групп атомов по отношению к плоскости двойной связи. Молекулы π-диастереомеров - ахиральны, поэтому для них не может быть энантиомеров. π-диастереомеры также обозначают как цис- и транс-стереоизомеры.
Не все соединения, содержащие двойную связь образуют π-диастереомеры. При наличии в молекуле двух одинаковых заместителей при одном атоме углерода с двойной связью х существование цис- и транс- изомеров невозможно.
НООС СООН НООС Н
\ / \ /
С = С С = С
/ \ / \
Н Н Н СООН
Малеиновая кислота Фумаровая кислота
Н3С СООН Н СООН
\ / \ /
С = С С = С
/ \ / \
Н Н СН3 Н
Изокротоновая Кротоновая
кислота кислота
СН3(СН2)7 (СН2)7СООН Н (СН2)7СООН
\ / \ /
С = С С = С
/ \ / \
Н Н СН3(СН2)7 Н
Олеиновая кислота Элаидиновая кислота
Для проявления биологической активности органических соединений имеет значение не только структура вещества, но и их конфигурация.
Пространственное строение органических молекул тесно связано с проявлением ими биологической активности или возможностью участия в биологических процессах.
В биохимический процесс, как правило, вводится только один из двух энантиомеров, либо только один диастереомер. Вещества с различной конфигурацией могут иметь разный вкус, неодинаковую, а иногда и противоположную биологическую активность.
Следствием стереоселективности взаимодействия живого с оптическими изомерами является, в частности, различие в терапевтической активности энантиомеров оптически активных лекарственных веществ.
Так холестерин содержит 8 хиральных центров, т.е. 256 оптических изомеров, между тем природный холестерин – единственный из всех возможных стереоизомеров.
Из двух энантиомеров более физиологически активный - называют эвтомер, второй (менее или физиологически неактивный) - дистомер.
В настоящее время приблизительно 40 процентов лекарственных веществ являются хиральными и только ничтожная часть этих соединений представлена индивидуальными энантиомерами. А энантиомеры обладают и различающимся фармакологическим действием.
Так, анальгетический препарат дарвон - это эвтомер, а его дистомер - лекарство против кашля.
Трагична история применения транквилизатора талидомида, использование которого беременными женщинами привело к огромному числу уродств у новорожденных, т.к. дистомер, присутствующий в равных количествах в препарате обладает тератогенным (вызывающим уродства) действием.
Существует проблема хиральной чистоты окружающей среды. В настоящее время производится масса хиральных соединений без их разделения и очистки, что приводит к загрязнению окружающей среды обитания такими препаратами, последствия чего пока даже трудно предугадать.
11.4. Реакционная способность гетерофункциональных соединений.
К гетерофункциональным производным, участвующим в процессах жизнедеятельности относят - аминоспирты, гидрокси- и аминокислоты, альдегидо- и кетокислоты, а также некоторые полигетерофункциональные соединения: двух- и трехосновные гидроксикислоты, полигидрокси- альдегиды и кетоны (углеводы) будут рассмотрены в теме углеводы.
Химические свойства этих соединений определяются свойствами соответствующих монофункциональных производных, однако наличие нескольких функциональных групп ведет к появлению специфических химических свойств, которые наиболее важны для обеспечения биологических функций.
В алифатических соединениях, приведенных на схеме
HOCH2-CH2NH2 -ОН аминоспирты
коламин -NH2
CH3-CHCOOH-COOH - СООН
│ -OH гидроксикислоты
OH
СН3-CHCOOH - СООН
│ -NH2 аминокислоты
NН2
СH3-C-COOH - СООН
║ >C=O кетокислоты
O
О
\\ -COH альдегидокислоты
C-COOH - COOH
/
H
функциональные группы проявляют электроноакцепторный характер. За
счет влияния друг на друга у них взаимно усиливается реакционная
способность, что связано с отрицательным индукционным эффектом
гетерофункциональных групп. Поскольку индукционный эффект затухает через 3-4 связи, важным обстоятельством является близость расположения функций в углеродной цепи. Различают α-,β-,γ- расположение. Каждая гетерофункциональная группа сохраняет свойственную ей реакционоспособность, но роисходит и взаимное усиление реакционной способности. В зависимости от расположения эти реакции могут протекать как внутри одной молекулы (внутримолекулярные), так и между молекулами (межмолекулярные).
α-расположение гетерофункциональных заместителей приводит, как правило, к реакциям межмолекулярной циклизации.
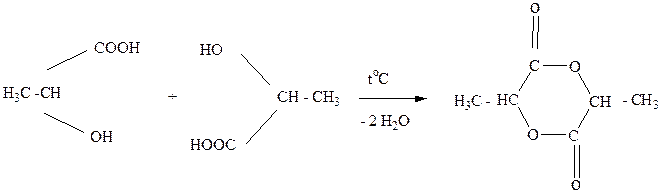
Молочная кислота Лактид молочной кислоты

α-аланин дикетопиперазин
При нагревании в кислой среде α-гидроксикислоты разлагаются с образованием муравьиной кислоты
O O
Н+, toС // //
СН3- СН – СООН → СН3-С + Н – С
│ -CO2 \ \
ОН Н ОН
β-расположение гетерофункциональных групп предопределяет нахождение между ними метиленовой группы СН2, которая испытывая влияние электроноакцепторных групп с двух сторон превращается в СН-кислотный центр, за счет повышения подвижности атома водорода.
β-расположение предполагает реакции элиминирования.
t
СH3 – CH ← CH → COOH → CH3 - CH = CH – COOH
↓ ↑ - Н2 О
ОН Н
β-гидроксимасляная кислота кротоновая кислота
У β-оксокислот появление СН-кислотного центра служит причиной таутомерии, т.е. динамической изомерии, когда одновременно сосуществуют две таутомерные кето- и енольная формы.
- С - СН - СООН ↔ - С = СН – СООН
║ │ │
О Н ОН
кето-форма енольная форма
Кето-енольная таутомерия характерна для β-оксокислот. Наиболее удобно рассмотреть кето-енольную таутомерию на примере ацетоуксусного эфира
О O
// //
Н3С - С - СН - С ↔ Н3С - С = СН – С
║ │ \ │ \
О Н ОС2Н5 ОН ОС2Н5
кето-форма (92,5%) енольная форма (7,5%)
Правило Ельтекова: соединения, в которых гидроксильная группа находится при атоме углерода с двойной связью неустойчивы, легко изомеризуются в соответствующие оксо-соединения.
Ацетоуксусный эфир используется для синтеза кетонов, карбоновых кислот, гетерофункциональных соединений, лекарственных препаратов, причем при действии на него какого либо реагента в реакцию вступает один из таутомеров и т.к. равновесие постоянно будет смещаться в его сторону, то таутомерная смесь реагирует как единое целое.
Если по отношению к карбоксильной группе в α- или β-положении находится сильная электроноакцепторная группа, то такие соединения способны к декарбоксилированию.
t0 O
//
CН3 – С – СООН → СН3 – С
║ - СО2 \
О Н
γ- расположение способствует реакциям внутримолекулярной циклизации, в результате образуются циклические сложные эфиры или амиды. Определяющим фактором становится термодинамическая устойчивость образующегося цикла. В связи с этим образующийся цикл как правило пяти- или шестичленный. Продуктами циклизации гидроксикислот являются лактоны, а аминокислот - лактамы:

γ - бутиролактон

γ- бутиролактам (пирролидон-2)
Для незамещенных по азоту лактамов возможна лактам-лактимная таутомерия:
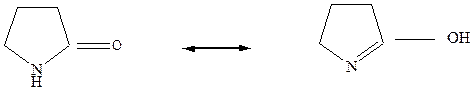
лактам лактим
Стремление к образованию термодинамически выгодных пяти- и шестичленных циклов лежит в основе явления, свойственного полигетерофункциональным соединениям, а именно к образованию хелатных
комплексных соединений (реакция хелатообразования).
Аминоспирты: коламин, димедрол, холин, катехоламины.
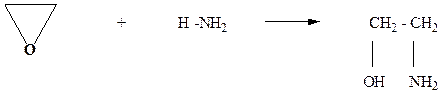 |
Коламин в лаборатории получают при действии аммиака на оксид этилена
Коламин представляет собой густую жидкость, смешивающуюся с водой с характерным запахом аминов. Коламин обладает хорошо выраженными основными свойствами, легко образует соли при взаимодействии с сильными кислотами.
НО-СН2-CH2-NH2 + HCl → НО-СН2-CH2-NH3+Cl-
 |
Димедрол относится к производным коламина, применяется в качестве противоаллергического лекарственного препарата со слабым снотворным эффектом.
Димедрол
Холин [HO – CH2 – CH2 – N(CH3)3]+OH- - гидроксид триметил-2-гидроксиэтиламмония входит в состав сложных липидов, используется как витаминоподобное вещество, регулирует жировой процесс, понижает кровяное давление. В оргаизме холин образуется из аминокислоты серина.
Декарбоксилаза N-метилтрансфераза
 СН2 - СН – СООН → СН2 – СН2 - NH2
СН2 - СН – СООН → СН2 – СН2 - NH2
│ │ │
ОН NH2 OH
серин коламин
О
CH3 CO -КоА ║
HO – CH2 – CH2 – N+ (CH3)3 → СН3 –С – О - СН2 – СН2 - N+(CH3)3
холин - КоАSH ацетилхолин
Ацетилхолин - нейромедиатор, действует на мускулатуру кишечника, вызывая его перистальтику. На основе ацетилхолина осуществлен синтез его производных, применяющихся в медицинской практике.
Катехоламины - к ним относят дофамин, норадреналин и адреналин, являющиеся биогенными аминами, которые образуются в организме из незаменимой аминокислоты фенилаланина.
Схема биосинтеза катехоламинов

Адреналин (метиламиноэтанолпирокатехин) образуется в надпочечниках, является гормоном, обладающим способностью сужать кровеносные сосуды, применяется в качестве кровоостанавливающего.
При стрессах в больших количествах выделяется в кровь (гормон страха). Активен только левовращающий природный изомер.
Гидроксикислоты -соединения, содержащие -ОН с -СООН группы. Различают α-,β-, и γ-гидроксикислоты.
НОСН2СООН 2-гидроксиэтановая кислота,
гликолевая кислота (α-кислота)
СН3-СН-СООН 2-гидроксипропановая кислота
│ молочная кислота (α-кислота)
ОН
НО-СН2-СН2-СООН 3-гидроксипропановая кислота,
гидракриловая кислота (β-кислота)
СН3-СН-СН2-СООН 3-гидроксибутановая кислота,
β-гидроксимасляная кислота
ОН
НО-СН2-СН2-СН2-СООН 4-гидроксибутановая кислота,
(ГОМК) (γ-кислота)
Гидроксикислоты проявляют общие свойства кислот и спиртов, кроме этого для них характерны специфические свойства, связанные с взаимным расположением спиртовой и карбоксильной групп.
Кетоновые (ацетоновые) тела -продукты окисления высших жирных кислот, накапливаются в организме у больных сахарным диабетом. К ним относятся - β-гидроксимасляная, ацетоуксусная кислоты и ацетон.
СН3-СН-СН2-СООН СН3-С-СН2-СООН СН3-С-СН3
║ ║
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2266; Нарушение авторских прав?; Мы поможем в написании вашей работы!