
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в системе раствор-осадок
|
|
|
|
Осмотическое давление, температуры кипения и отвердевания растворов слабых электролитов
Вант-Гофф (1887 г.) установил, что определенные экспериментально значения осмотического давления, температуры отвердевания и кипения растворов слабых электролитов не совпадают с рассчитанными по формулам для неэлектролитов величинами.
Вант-Гофф ввел в формулы законов Рауля поправочный коэффициент, названный изотоническим (i). Введение изотонического коэффициента позволило использовать формулы для расчета ∆росм, ∆Тотв, ∆Ткип:
росм =iс2RT
∆Ткип = i ∙Е∙m;
∆Тотв =i ∙К∙m
i - зависит от природы раствора и его концентрации, но для одного и того же раствора одинаков во всех уравнениях.
Растворы с одинаковым осмотическим давлением называют изотоническими.
Закон действия масс применим к гетерогенной равновесной системе, состоящей из кристаллов малорастворимого электролита (соли, основания, кислоты) и его ионов в насыщенном растворе:
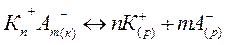
Константа равновесия для данной системы:
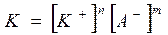 - величина постоянная при данной температуре и называется произведением растворимости
- величина постоянная при данной температуре и называется произведением растворимости

Зная произведение растворимости (табличная величина, но может быть рассчитана через ∆G соответствующей реакции диссоциации), можно:
- вычислить растворимость вещества, т.е. его концентрацию в насыщенном растворе;
- установить выпадет или нет данное соединение в осадок из раствора с известной концентрацией.
Пример. Определить растворимость PbCl2 в воде при 25 0С, если
ПРPbCl2=2,12 ∙10-5
PbCl2(к) ↔ Pb2+(р) + 2Cl-(р)
ПРPbCl2 = [Pb2+][Cl-]2;
[PbCl2] = [Pb2+]; [Cl-] = 2[Pb2+];
ПРPbCl2 = [Pb2+](2[Pb2+])2 = 4[Pb2+]3;

|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 911; Нарушение авторских прав?; Мы поможем в написании вашей работы!