
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз – это взаимодействие веществ с водой
|
|
|
|
Гидролиз солей
Водные растворы в неорганической химии
Задачи
- Рассчитайте ионную силу растворов следующего состава: 1) 0,005 М НСl + 0,001 M CaCl2; 2) 0,005 M Sr(OH)2 + 0,01 M NaCl.
- Напишите уравнения ступенчатой диссоциации Pb(OH)2 и Н3ВО3 и выражения для констант диссоциации по каждой из ступеней.
- Чему равна растворимость соли Ag2SO4 в моль\л, если ПPAg2SO4 = 7,7 10-5?
Лекция 12
Железо ржавеет, не находя себе применения,
стоячая вода гниет или на холоде замерзает, а ум человека,
не находя себе применения чахнет.
Леонардо да Винчи
Гидролизу могут подвергаться химические соединения различных классов: соли, углеводы, белки, эфиры, жиры и другие вещества.
При гидролизе солей образуются основание и кислота; при гидролизе соединений неметаллов обычно образуются две кислоты, например:
 РСl3 + 3HOH H3PO3 + 3HCl
РСl3 + 3HOH H3PO3 + 3HCl
(формулу воды в уравнениях гидролиза удобно записывать в виде НОН).
В неорганической химии чаще всего рассматривают гидролиз солей, т.е. обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды.
Гидролиз – результат поляризационного взаимодействия ионов соли с их гидратной оболочкой в водном растворе. Чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз.
В результате гидролиза солей образуются слабое основание, слабая кислота или одновременно слабое основание и слабая кислота. В силу этого обстоятельства растворы гидролизующихся солей имеют рН, отличный от нейтрального. рН солей, подвергающихся гидролизу, определяется продуктами реакции взаимодействия с водой: если в результате гидролиза образуется сильная кислота и слабое основание раствор соли имеет кислую реакцию, в случае сильного основания и слабой кислоты – щелочную, а при полном гидролизе (образовании слабого основания и слабой кислоты) рН раствора соли приблизительно равен 7 (нейтральная среда).
Концентрация Н+, моль\л
10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14
1 2 3 4 5 6 7 8 9 10 11 12 13 14
рН = - lg[Н+]
Различают 4 варианта действия воды на соли.
- Соли, образованные анионом сильной кислоты и катионом сильного основания, гидролизу не подвергаются:

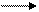 К+ + Сl- + НОН
К+ + Сl- + НОН
рН = 7
- Соли, образованные анионом слабой кислоты и катионом сильного основания, гидролизуются по аниону:
СН3СООNa +HOH ↔CH3COOH + NaOH – молекулярная форма уравнения
СН3СОО- + Na+ +HOH ↔CH3COOH + Na+ + OH- - полная ионная форма
СН3СОО- +HOH ↔CH3COOH + OH- - сокращенная ионная форма
рН >7 – щелочная среда
- Соли, образованные анионом сильной кислоты и катионом слабого основания, гидролизуются по катиону:
NH4Cl + HOH ↔ NH4OH + HCl
NH4+ + Cl- + HOH ↔ NH4OH + H+ + Cl-
NH4+ + HOH ↔ NH4OH + H+
рН <7 – среда кислая
- Соли, образованные катионом слабого основания и анионом слабой кислоты, гидролизуются по катиону и аниону, т.е. полностью:
NH4СН3СОО + HOH ↔ NH4OH + СН3СООH
NH4+ + СН3СОО- + HOH ↔ NH4OH + СН3СООH
рН ≈7
Количественно гидролиз характеризуется:
степенью гидролиза – отношение числа молекул, подвергшихся гидролизу, к общему числу молекул:
α= СГ\С, где
СГ и С – молярная концентрация гидролизованной части вещества и общая молярная концентрация растворенного вещества.
константой гидролиза КГ:
КА + НОН↔КОН +НА
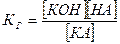
при гидролизе соли по аниону константа равновесия:
 , т.к.
, т.к. 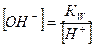 , то
, то 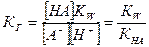 или
или
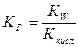 , где
, где
КНА= Ккисл – константа диссоциации кислоты;
при гидролизе соли по катиону константа гидролиза:
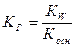 , где
, где
Косн – константа диссоциации основания;
при полном гидролизе соли константа гидролиза:
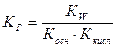
Для солей, содержащих многозарядный анион или катион, возможен ступенчатый гидролиз:
I ступень Na3PO4 + HOH↔ Na2HPO4 + NaOH
PO43- + HOH↔ HPO42- + OH-
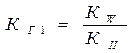
II ступень Na2HPO4 + HOH↔ NaH2PO4 + NaOH
HPO42- + HOH↔ H2PO4- + OH-

КIкисл > КIIкисл, поэтому КГ1>КГ2
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 596; Нарушение авторских прав?; Мы поможем в написании вашей работы!