
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Предельные углеводороды
|
|
|
|
Задачи
1. Каковы особенности электронного строения атома углерода? Какие виды гибридизации реализуются при образовании им ковалентных связей?
2. Каковы основные положения теории строения органических веществ А.М. Бутлерова?
3. Составьте структурные формулы всех изомеров состава: а) С5Н12; б) С7Н16. Среди этих изомеров отметьте углеводороды нормального и изостроения. Все изомеры назовите по систематической номенклатуре.
4. Напишите формулы следующих углеводородов: а) 2,3-диэтилпентан; б) 2,2- диметилпропан; в) 2-метил-3-этилпентан.
5. Какие из нижеприведенных соединений являются гомологами метана:
С2Н4; С3Н8; С10Н20; С6Н6; С6Н12; С12Н26?
Лекция 15
Строение и свойства важнейших классов органических соединений
Строение
. Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы:
метан Н этан Н Н пропан Н Н Н
│ │ │ │ │ │
Н ─ С ─ Н Н─С ─ С─ Н Н─ С ─ С ─ С ─ Н
│ │ │ │ │ │
Н Н Н Н Н Н
. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 - для углерода и 2.1 - для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул:

Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации. Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации. В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (s-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя s-связи С-Н или С-С.
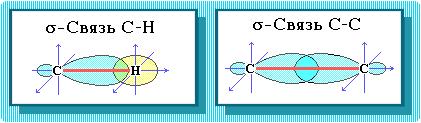

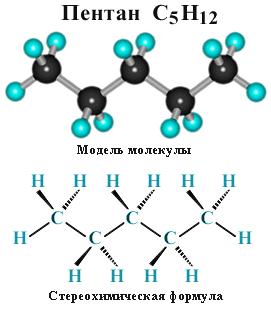
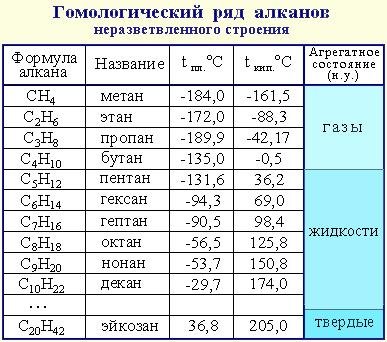
Физические свойства
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Галогенирование:
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть
CH4 + Cl2 → CH3Cl (хлорметан) + HCl
CH3Cl + Cl2 → CH2Cl2 (дихлорметан) + HCl
CH2Cl2 + Cl2 → CHCl3 (трихлорметан) + HCl
CHCl3 + Cl2 → CCl4 (тетрахлорметан) + HCl.
Нитрование (реакция Коновалова)
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.
RH + HNO3 = RNO2 + H2O
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 = CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2= nCO2 + (n+1)H2O
Каталитическое окисление
Могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 (катализатор, кислород, 200 °C) могут образоваться:
· метиловый спирт: СН4 + О2 = СН3ОН
· формальдегид: СН4 + О2 = СН2О + Н2O
· муравьиная кислота: СН4 + О2 = НСООН
Термические превращения алканов
Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH4 = C + 2H2 (t > 1000 °C)
C2H6 = 2C + 3H2
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
Для метана:
CH4 = С + 2H2 -- при 1000 °C
Частичный крекинг:
2CH4 = C2H2 + 3H2 -- при 1500 °C
Дегидрирование
Условия протекания: 400--600 °C, катализаторы -- Pt, Ni, Al2O3, Cr2O3
а)CH3-CH3 = CH2=CH2 + H2 (этан > этен)
б)CH3-CH2-CH3 = CH2=CH-CH3 + H2 (пропан > пропен)
в)CH3-CH2-CH2-CH3 = CH2=CH-CH=CH2 + H2 (бутан > бутадиен-1,3)
 |
г) CH3-CH2-CH2-CH2-CH2-CH3 = +4Н2 (гексан > бензол)
Изомеризация
Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
Конверсия метана
В присутствии никелевого катализатора протекает реакция:
CH4 + H2O = CO + H2
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 3216; Нарушение авторских прав?; Мы поможем в написании вашей работы!