
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Непредельные углеводороды
|
|
|
|
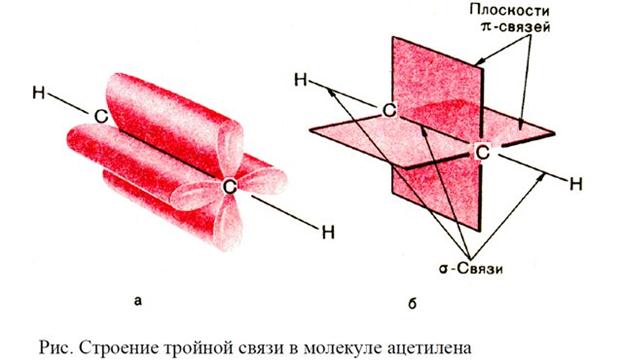
Строение
Простейший непредельный углеводород с двойной связью - этилен С2Н4 (СН2=СН2) начинает ряд этиленовых углеводородов (алкены). Состав любого углеводорода этого ряда выражает формула СnH2n (где n - число атомов углерода).
Состав членов гомологического ряда непредельных ацетиленовых (алкины) углеводородов (стройной связью), родоначальником которых является ацетилен С2Н2 или СН≡СН, выражается общей формулой СnH2n-2.
Общая формула СnH2n-2 выражает также состав углеводородов с двумя двойными связями
С4Н6 - бутадиен (дивинил) СН2= СН ─ СН =СН2
С5Н8 - 2-метилбитадиен (изопрен) СН2=С─СН=СН2
│
СН3
Известны углеводороды с большим числом двойных (полиены) и тройных (полиины) связей.

Физические свойства этиленовых и ацетиленовых углеводородов в гомологических рядах изменяются с той же закономерностью, что и у предельных; низшие представители - газы, более сложные - жидкости, а затем - вещества с постепенно возрастающими температурами плавления и кипения, находящимися при обычных условиях в твердом состоянии.
Химические свойства
По химическим свойствам непредельные углеводороды резко отличаются от предельных; они исключительно реакционноспособны и вступают в разнообразные реакции присоединения. Такие реакции происходят путем присоединения атомов или групп атомов к атомам углерода, связанным двойной или тройной связью. При этом кратные связи довольно легко разрываются и превращаются в простые.
Реакции присоединения (гагогенирование, гидрирование, гидрогалогенирование, гидротация, сульфатация)
СН2=СН2 + Br2 → CH2Br ─ CH2Br
этилен дибромэтилен
СH≡CH + Br2 → CHBr = CHBr ++ Br2 →CHBr2─ CHBr2
ацетилен дибромэтилен тетрабромэтилен
Окисление
СН2=СН2 + О2 → 2СО2 + 2Н2О
Окисление перманганатом калия KMnO4 (качественная реакция)
3 СН2=СН2 + KMnO4 (разбавленный р-р) +4Н2О→3 CH2−CH2+ 2MnO2 + 2KOH
│ │
ОН ОН
этиленгликоль
О О
t,0C ║ ║
CH3−CH=CH−CH2−CH3 + KMnO4 (концентр. р-р) + Н2SO4 → CН3−С + С − СН2−СН3 +.......
│ │
ОН ОН
уксусная к-та пропионовая к-та
Реакция полимеризации
Полимеризация вызывается нагреванием, давлением, облучением, действием свободных радикалов или катализаторов. В упрощенном виде такую реакцию на примере этилена можно представить следующим образом:
kat
n СН2=СН2 → (− CH − CH −)n
этилен полиэтилен
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1221; Нарушение авторских прав?; Мы поможем в написании вашей работы!