
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома
|
|
|
|
До сих пор рассматривались вопросы взаимодействия излучения с веществом. Эти явления должны быть тесно увязаны со строением атомов и молекул, так как излучение рождается в их недрах. Однако рассмотрение начнем с введения подходящих единиц измерения. Неразумно измерять радиус атома в метрах или скорость электрона в км/час. Необходимо найти подходящие единицы. Уже из одного такого введения единиц сразу же возникают важные следствия.
Так, из заряда электронов е и его массы m нельзя составить величину, имеющую размерность длины. Это значит, что в классической физике атом невозможен – электрон не может двигаться стационарно. Положение изменилось с появлением постоянной Планка ħ. Эта величина имеет размерность энергии, умноженной на время. Это позволяет составить величину, имеющую размерность длины  (в гауссовской системе единиц). Если в это уравнение подставить значения входящих сюда постоянных, то получается величина порядка размеров атома
(в гауссовской системе единиц). Если в это уравнение подставить значения входящих сюда постоянных, то получается величина порядка размеров атома 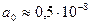 см. Эта величина сопоставима с размером атома.
см. Эта величина сопоставима с размером атома.
Величина 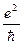 имеет размерность скорости, она приблизительно в 100 раз меньше скорости света с. Если поделить эту величину на скорость света, получится безразмерная величина
имеет размерность скорости, она приблизительно в 100 раз меньше скорости света с. Если поделить эту величину на скорость света, получится безразмерная величина 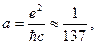 характеризующая взаимодействие электрона с электромагнитным полем. Эта величина получила название постоянной тонкой структуры.
характеризующая взаимодействие электрона с электромагнитным полем. Эта величина получила название постоянной тонкой структуры.
Ключом к строению атомов явилось изучение атомных спектров. Было замечено, что излучение невзаимодействующих атомов состоит из отдельных спектральных линий. В соответствии с этим спектр испускания атомов называется линейчатым. Отдельные линии в спектрах расположены не беспорядочно, а объединяются в группы или серии линий. Отчетливее всего это проявляется в спектрах простейшего атома – атома водорода. Частоты линий излучения атома водорода могут быть точно представлены обобщенной формулой Бальмера
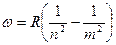 , (1.21)
, (1.21)
где 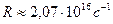 - постоянная Ридберга, n и m – целые числа, не равные нулю. При n = 1 (m = 2, 3, 4, …) наблюдается так называемая серия Лаймана, располагающаяся в ультрафиолетовой части спектра, при n = 2 (m = 3, 4, 5, …) – серия Бальмера в видимой части света, при n = 3 (m = 4, 5, 6,…) – серия Пашена в инфракрасной части спектра и т.д. Согласно классическим представлениям, атом может испускать монохроматическую волну (т.е. отдельную спектральную линию), если электрон в излучающем атоме является гармоническим осциллятором. В 1903 г. Дж. Томсон предложил модель атома, согласно которой атом представляет собой равномерно заряженный положительным зарядом шарик, внутри которого колеблется электрон. Сам атом в целом электрически нейтрален. Несостоятельность этой модели заключается в том, что при колебаниях электрон должен излучать не монохроматическую волну и, в конце концов, колебания должны исчезнуть. Резерфорд, основываясь на опытах по рассеянию α-частиц тонкими слоями вещества, пришел к ядерной модели атома. Согласно этой модели, атом представляет собой систему зарядов, в центре которой находится тяжелое ядро с зарядом Ze (Z – порядковый номер элемента по таблице Менделеева) и размерами, превышающими 10-13 см. Вокруг ядра распределены по всему объему атома Z электронов. Размер атома порядка 10-8 см. И почти вся масса атома сосредоточена в ядре.
- постоянная Ридберга, n и m – целые числа, не равные нулю. При n = 1 (m = 2, 3, 4, …) наблюдается так называемая серия Лаймана, располагающаяся в ультрафиолетовой части спектра, при n = 2 (m = 3, 4, 5, …) – серия Бальмера в видимой части света, при n = 3 (m = 4, 5, 6,…) – серия Пашена в инфракрасной части спектра и т.д. Согласно классическим представлениям, атом может испускать монохроматическую волну (т.е. отдельную спектральную линию), если электрон в излучающем атоме является гармоническим осциллятором. В 1903 г. Дж. Томсон предложил модель атома, согласно которой атом представляет собой равномерно заряженный положительным зарядом шарик, внутри которого колеблется электрон. Сам атом в целом электрически нейтрален. Несостоятельность этой модели заключается в том, что при колебаниях электрон должен излучать не монохроматическую волну и, в конце концов, колебания должны исчезнуть. Резерфорд, основываясь на опытах по рассеянию α-частиц тонкими слоями вещества, пришел к ядерной модели атома. Согласно этой модели, атом представляет собой систему зарядов, в центре которой находится тяжелое ядро с зарядом Ze (Z – порядковый номер элемента по таблице Менделеева) и размерами, превышающими 10-13 см. Вокруг ядра распределены по всему объему атома Z электронов. Размер атома порядка 10-8 см. И почти вся масса атома сосредоточена в ядре.
Однако и ядерная модель оказалась в противоречии с законами классической механики и электродинамики. В соответствии с классической теоремой Ирншоу о невозможности устойчивого равновесия в системе неподвижных зарядов, Резерфорд отказался от статической модели атома и предположил, что электроны движутся по замкнутым траекториям вокруг ядра. При таком движении электроны, обладая ускорением, обязаны излучать электромагнитные волны. Это, конечно, положительный момент, но с другой стороны процесс излучения должен сопровождаться потерей энергии, так что в конечном итоге электрон должен упасть на ядро, и атом прекращает свое существование. Этого не происходит в природе – реальный атом длительное время имеет определенные размеры и частоты излучения. Кроме того, излучаемая атомом энергия неизмеримо меньше той, которая выделилась бы при падении электрона на ядро.
Выход из создавшегося тупика был найден в 1913 г Нильсом Бором ценой введения предположений, в корне противоречащих классическим представлениям. Бор работал в лаборатории Резерфорда несколько месяцев и хорошо знал о ядерной модели атома. Он считал, что в целом модель Резерфорда верна, но для избавления от ее недостатков необходимо как-то привлечь идею квантов. Квантовая гипотеза Планка в своей первоначальной форме утверждала, что каждой спектральной линии соответствует гармонический осциллятор с определенной частотой ω, который в отличие от классической теории может поглотить или испустить не произвольную порцию энергии, а только целое число элементарных порций ħω. Бор же отказался от представления о том, что электроны в самом деле ведут себя как осцилляторы. Основные идеи Бора были высказаны им в следующих постулатах.
- Электроны могут двигаться вокруг ядра только по отдельным (разрешенным) орбитам без излучения энергии (так как энергия движения сохраняется, то эти орбиты называются стационарными) – не правда ли своеобразный способ объяснять стационарность атома – просто постулировать данный факт!
- Испускание света происходит при переходе электрона из стационарного состояния с бóльшей энергией Е n в стационарное состояние с меньшей энергией Е m. При
 каждом таком переходе излучается квант энергии ħω. Его величина рана разности энергий стационарных состояний, между которыми совершается квантовый переход:
каждом таком переходе излучается квант энергии ħω. Его величина рана разности энергий стационарных состояний, между которыми совершается квантовый переход:
 (1.22)
(1.22)
При поглощении света атом переходит из состояния с меньшей энергией в состояние с бóльшей энергией. Учитывая факт существования узких спектральных линий поглощения и излучения, и исходя из гипотезы световых квантов Эйнштейна следует вывод, что атом может находиться только в определенных дискретных стационарных состояниях с энергией 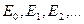 Таким образом, атом может поглощать лишь излучения таких частот, что
Таким образом, атом может поглощать лишь излучения таких частот, что  равно как раз той порции энергии, которая нужна для перевода атома из одного стационарного состояния в другое, более высокое. Поэтому линии поглощения определяются уравнениями
равно как раз той порции энергии, которая нужна для перевода атома из одного стационарного состояния в другое, более высокое. Поэтому линии поглощения определяются уравнениями

где E 0 – энергия самого низкого состояния, которое характерно для атомов в отсутствие каких-либо внешних влияний. Если по какой либо причине атом возбуждается, т.е. переходит в состояние с энергией Е n > E 0, то он может вернуть эту энергию в виде излучения. Следовательно, он может испустить любые световые кванты, энергия которых в точности рана разности энергий каких-то стационарных состояний. Поэтому линии излучения определяются уравнением

Первым подтверждением теории служит следующий факт. Коль скоро гипотеза Бора соответствует действительности, то возбужденный атом может возвращаться в основное состояние различными путями, отдавая каждый раз избыток энергии излучаемым квантам. Например атом в третьем возбужденном состоянии может либо непосредственно вернуться в основное состояние (при этом испущенный световой квант будет обладать частотой v 30, так как разница в энергиях равна Е 3 – Е 0), либо например, перейти сначала в первое возбужденное состояние Е 1 (испустив квант энергии ħν 31), а уже затем – в основное (что соответствует частоте v 10) и т.д. (рис. 9). Поскольку в совокупности испущенная энергия во всех случаях, несомненно, остается одной и той же, а именно равной Е 3 – Е 0, частоты должны подчиняться следующим соотношениям:
v 30 = ν 31 + v 10 = ν 32 + v 20 = ν 31 + v 21 + v 10.
Данное соотношение хорошо известно как комбинационный принцип Ритца.

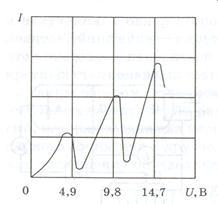
Рис. 9. Рис. 10. Рис. 11.
Другое непосредственное подтверждение боровской теории дискретных атомных уровней дал опыт Франка и Герца (1914). Если атомы каким-то путем получают энергию, например, в результате взаимодействия с электронами при бомбардировке вещества электронным пучком, то поглощение энергии происходит как раз такими порциями, которые соответствуют энергиям возбуждения атома.
Схема установки Франка и Герца приведена на рис. 10. В трубке, заполненной парами ртути под небольшим давлением, имеется три электрода: катод К, сетка С и анод А. При разогреве катода из него вылетают электроны и ускоряются напряжением U, приложенным между катодом и сеткой. Это напряжение можно плавно изменять с помощью потенциометра П. Между сеткой и анодом создавалось слабое электрическое поле (разность потенциалов порядка 0,5 В), тормозившее движение электронов от сетки к аноду.
На рис. 11 представлена зависимость силы тока в цепи анода I от напряжения U между катодом и сеткой. Плавное нарастание тока сменяется его резким падением при напряжениях 4,9; 9,8; 14,7 В и т.д. Такое своеобразное поведение кривой связано с тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию только порциями величиной
Δ Е 1 = Е 1 - Е 0, либо Δ Е 2 = Е 2 - Е 0 и т.д., где Е 0 – энергия основного невозбужденного состояния, Е 1, Е 2, … - энергия возбужденных состояний. До тех пор, пока энергия бомбардирующего электрона меньше Δ Е 1, соударения с атомами ртути носят упругий характер, и так как масса электрона много меньше массы ртути, энергия практически не изменяется. Часть электронов попадает на сетку, остальные ее проскакивают и создают ток в цепи анода. И чем больше ускоряющее напряжение U, тем больше сила тока. Когда же энергия, получаемая электроном, становится равной значению Δ Е 1 = 4,9 эВ, соударения перестают носить упругий характер – электроны передают атомам ртути энергию Δ Е 1 = 4,9 эВ и не могут преодолеть задерживающее поле между сеткой и анодом. При напряжении 9,8 В электрон на пути катод – анод может дважды испытать неупругое соударение с атомами ртути, теряя при этом энергию 9,8 эВ, вследствие чего сила тока также будет резко падать. Аналогичная ситуация возникает и при напряжении 14,7 В и т.д.
Таким образом, опыты Франка и Герца явились прямым доказательством у атомов дискретных энергетических уровней. Бор знал об экспериментальной формуле Бальмера (1.21) и понял, что для ее объяснения ему придется предложить еще одно условие:
- Из всех возможных с точки зрения классической механики круговых орбит движения электрона реализуются только те, для которых момент импульса электрона кратен постоянной Планка ħ:
L = mvr = n ħ (n = 1, 2, 3, …). (1.23)
Это утверждение отражает условие квантования орбит. Единственным аргументом в его пользу было то, что оно позволило достичь согласия с наблюдаемыми спектрами.
Рассмотрим электрон, движущийся по круговой орбите радиуса r в кулоновском поле тяжелого атомного ядра с зарядом Ze (при Z = 1 такая система соответствует атому водорода). Уравнение движения электрона имеет вид
 (1.24)
(1.24)
где  Исключая из уравнений (1.23) и (1.24) скорость электрона v, получаем выражение для радиусов допустимых орбит:
Исключая из уравнений (1.23) и (1.24) скорость электрона v, получаем выражение для радиусов допустимых орбит:
 (n = 1, 2, 3,…). (1.25)
(n = 1, 2, 3,…). (1.25)
Значение n называют главным квантовым числом. Радиус первой орбиты водородного атома называют боровским радиусом, и его принято обозначать как r 0 (а не r 1). Его значение равно
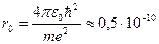 м.
м.
Заметим, что классическая физика вообще не дает значения размеров атома. На каждой орбите (в каждом состоянии) электрон обладает энергией
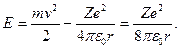
Подставляя сюда значение rn по формуле (1.25), находим разрешенные значения энергии

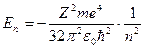 (n = 1, 2, 3, …) (1.26)
(n = 1, 2, 3, …) (1.26)
Уровень Е 1 соответствует энергии основного (невозбужденного) состояния с наименьшей энергией. Его значение для атома водорода равно
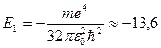 эВ.
эВ.
Если электрону сообщить такую энергию, то он покидает пределы атома, поэтому это значение называется энергией ионизации. Значения Е 2, Е 3, … соответствуют возбужденным состояниям.
При комнатных температурах атомы водорода находятся в основном состоянии. При повышении температуры или в газовом разряде электроны переходят в возбужденное состояние со «временем жизни» τ ~ 10-8 с. Затем при переходе в основное состояние излучается квант света. Так возникают спектры излучения. Если через водород пропускать другой свет, то атомы отбирают только те линии, которые соответствуют разности энергий каких –либо состояний – так возникают спектры поглощения.
Рассмотрим, как формула (1.26) позволяет объяснить закономерности спектрального состава излучения атома водорода. При переходе атома из состояния с номером m в состояние с номером n < m излучается фотон, энергия которого в соответствии с формулами (1.22) и (1.26) равна

а частота
 (1.27)
(1.27)
Таким образом, мы пришли к обобщенной формуле Бальмера (1.21), причем для постоянной Ридберга получили значение
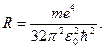
При подстановке в это выражение значений всех констант получается величина, превосходно согласующаяся с экспериментальным значением постоянной Ридберга.
Теория Бора была крупным шагом в развитии представлений о строении атома. Прежде всего, она гарантировала устойчивость атома водорода, так нет состояний с более низкой энергией. Она превосходно все закономерности спектров испускания и поглощения атома водорода. Теория Бора с полной отчетливостью показала неприменимость классической физики к внутриатомным явлениям и подчеркнула особую роль квантовых законов.
В то же время после первых успехов этой теории все яснее давали себя знать ее недостатки. Особенно тягостной была неудача всех попыток построения теории атома гелия – одного из простейших атомов, следующего за атомом водорода.
Самой слабой стороной теории Бора была ее внутренняя логическая противоречивость: она не была ни последовательно классической, ни последовательно квантовой; эта теория могла быть только переходным этапом на пути создания последовательной теории строения атомов.
Глава 2. Основные принципы квантовой механики
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 536; Нарушение авторских прав?; Мы поможем в написании вашей работы!