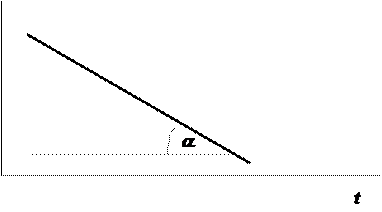КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции первого порядка
|
|
|
|
Для произвольной реакции 1-го порядка вида
А ® продукты реакции
уравнение закона действующих масс выглядит так:
| d С v = - ¾¾ = kC, d t |
где С - концентрация вещества А. После разделения переменных
| d С k d t = - ¾¾ C |
это уравнение можно интегрировать в интервалах = 0 ¸ t, и С 0 ¸ Сt:
| t Ct d С k ò d t = - ò ¾¾, 0 C0 C |
получая при этом
k (t - t0) = - (ln Ct - ln C0)
или
k (t - t0) = ln C0 - ln Ct,
откуда, принимая t0 = 0, получаем окончательное кинетическое уравнение для расчёта константы скорости реакции первого порядка:
| 1 С0 k = ¾ ln ¾¾. (12.4) t Ct |
где С0 - начальная концентрация исходного вещества; Ct - концентрация, измеренная в момент времени t.
Из этого уравнения следует, что константу скорости реакции 1-го порядка можно определить графически, если построить график зависимости
ln С от времени. При этом тангенс угла наклона графика равен - k (рис. 12.2).
Строя график зависимости ln С от t для неизвестной реакции и получая при этом прямую линию, подобную изображённой на рис. 12.2, можно убедиться в том, что реакция имеет первый порядок.
Константа скорости может быть определена и без построения графика, а именно, как среднее арифметическое из величин, полученных при расчёте по уравнению (12.4) для нескольких текущих концентраций исходного вещества, экспериментально измеренных в различные моменты времени.
Так как в уравнение (12.4) входит отношение начальной и текущей концентраций, то в принципе оно может быть заменено отношением любых
Рис. 12.2. Зависимость ln С - t для реакции первого порядка |
других величин, пропорциональных концентрации (например, углов вращения плоскости поляризации реакционной смеси или её оптической плотности и т. п.), а сама концентрация может быть выражена любыми способами. Часто при вычислениях используют не концентрацию, а количество вещества в молях. Тогда расчётное уравнение для константы скорости будет выглядеть так:
| 1 а k = ¾ ln ¾¾¾, (12.5) t а- х |
где а - начальное число молей исходного вещества, x - число молей его, прореагировавшее к моменту времени t.
С помощью уравнений (12.4) и (12.5) могут быть вычислены (если известна константа скорости) и другие важные кинетические характеристики, например, время полупревращения какой-либо реакции или, что представляет особый интерес для фармации, срок годности лекарственных препаратов.
Время полупревращения (t 1/2) реакции удобно вычислять с помощью преобразованного уравнения (12.5):
| 1 а t = ¾ ln ¾¾¾. k а - х |
Принимая х = а /2, получим:
| 1 а 1 0,693 t 1/2 = ¾ ln ¾¾¾ = ¾ ln 2 = ¾¾¾, (12.6) k а - а /2 k k |
Это же выражение можно получить, используя уравнение (12.4) и принимая Ct = C0 /2.
Из уравнения (12.6) следует, что время полупревращения реакции первого порядкане зависит от начальной концентрации вещества. То есть для уменьшения концентрации, например, от 1 до 0,5 М потребуется ровно столько же времени, сколько для уменьшения концентрации от 0,001 до 0,0005 М. Из уравнения (12.6) следует также, что по экспериментально найденному значению t 1/2 можно вычислить константу скорости реакции:
| 0,693 k = ¾¾¾. t 1/2 |
Реакции разложения многих лекарственных веществ, особенно реакции, идущие в растворах, являются реакциями первого или псевдопервого порядка, поэтому срок годности их тоже может быть рассчитан по кинетическому уравнению (12.5). Согласно действующей нормативной документации лекарственный препарат считается годным к употреблению, если содержание лекарственного вещества в нём отвечает требованиям соответствующей фармакопейной статьи. Принимая, что в свежеприготовленном препарате количество наиболее быстро разлагающегося вещества а = 100%, а допустимый процент разложения лекарственного вещества равен х, можно, зная константу скорости разложения данного вещества при температуре его хранения, по уравнению
| 1 100 t = ¾ ln ¾¾¾¾. k 100 - х |
вычислить ориентировочный срок его годности.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 574; Нарушение авторских прав?; Мы поможем в написании вашей работы!