
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы идеального газа
Идеальным называют газ, при описании свойств которого можно пренебречь размерами молекул и их взаимодействием между собой.
Поэтому в модели идеального газа происходит хаотическое движение материальных точек, которые взаимодействуют между собой только в результате упругого столкновения.
Для описания состояния системы используются, как уже отмечалось, макроскопические параметры: объем V, давление P, температура Т и масса m. Описание состояния системы заключается в установлении связи между ними. Математическое уравнение, описывающее эту связь, называют уравнением состояния. В случае идеального газа такие связи установлены при условии, когда один или два макропараметра системы постоянны. Эти зависимости носят название изопроцессов.
Процесс, при котором давление и объем газа меняются, а масса и температура газа являются постоянными величинами, называется изотермическим (m=const, T=const). В этом случае между давлением и объемом установлена обратная связь:
PV=const, m=const, T=const. (6.4.1)
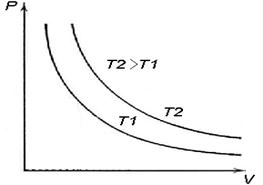
Этот закон экспериментальным путем был открыт Бойлем и Мариоттом одновременно и получил название закона Бойля – Мариотта [5]. На рис. 6.10 представлена зависимость P = P(V), кривые для разных температур носят название изотерм.
Экспериментально были установлены линейные зависимости объема и давления идеального газа от температуры V=V(T) и P=P(Т), которые получили название законов соответственно Шарля и Гей-Люсcака (по фамилиям авторов этих законов):
P=P0(1+αt), m=const, V=const – закон Гей-Люссака[6] (6.4.2)
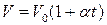 , m=const, P=const - закон Шарля, (6.4.3) где α – коэффициент объемного расширения или увеличения давления α=1/273 град-1.
, m=const, P=const - закон Шарля, (6.4.3) где α – коэффициент объемного расширения или увеличения давления α=1/273 град-1.
а)
б) в)
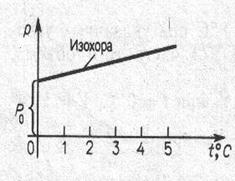
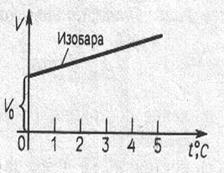
Рис. 6.10. Законы идеального газа: (а) закон Бойля – Мориотта (изотермы для T2>T1.), (б) закон Шарля, (в) закон Гей – Люсакка.
Законы Шарля и Гей-Люсcака с использованием абсолютной температурной шкалы записываются соответственно в виде:
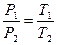 , (6.4.4)
, (6.4.4)
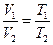 . (6.4.5)
. (6.4.5)
Из установленных экспериментально законов изменения состояния идеального газа (6.4.1), (6.4.4) и (6.4.5) следует:
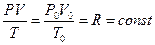 , (6.4.6)
, (6.4.6)
где R=8.31 Дж/моль×К называют универсальной газовой постоянной, а упомянутые законы являются частными случаями более общего уравнения газового состояния, которое называют уравнением Клапейрона.
Уравнение Клапейрона – Менделеева[7] для произвольной массы идеального газа учитывает также и количество молей газа:
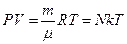 , (6.4.7)
, (6.4.7)
где 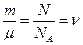 - число молей газа,
- число молей газа, 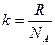 .
.
Законы Бойля – Мориотта, Гей-Люсакка и уравнение газового состояния являются частными случаями уравнения Клапейрона – Менделеева.
Постоянство величины R для разных газов представляет гениальное отражение простоты природы. Итальянский ученый Амедео Авогадро[8] (1776-1856) установил, что равные объемы газов при равных давлениях и температурах имеют одинаковое число молекул N. Это видно из уравнения газового состояния, переписанного в виде:
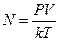 , (6.4.8)
, (6.4.8)
где k – постоянная Больцмана. При нормальных условиях газа, когда Т0=00С, Р0= 1атм, V0=22.4 м3 для любого вида газа количество молекул, называемое числом Авогадро, составляет:
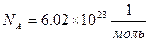 (6.4.9)
(6.4.9)
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов (законДальтона):
Р=Р1+Р2+Р3+ …+Рn, (6.4.10)
причем каждый газ в смеси создает парциальное давление, пропорциональное его молекулярной концентрации. Давление воздуха, например, складывается из давления азота, кислорода и углекислого газа, причем оно пропорционально доле их масс в общей массе воздуха.
Пример 6.3. На основе законов термодинамики действует установка вакуум-градиент терапии (рис.6.11). Суть установки заключается в использовании хорошо известных «банок», подключенных к форвакуумным насосам. С их помощью изменяют давление в банках, откачивая из них воздух. Банками осуществляется массаж тела. Причем давление в банках может быть как постоянным, так и изменяться в процессе процедуры. Это позволяет рассасывать застойные подкожные скопления лимфы, крови и других отложений.
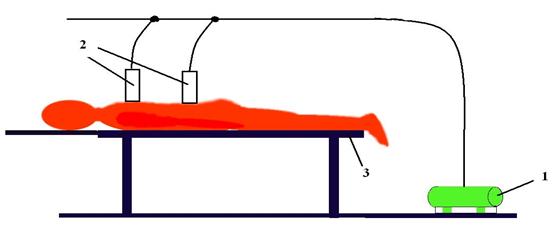
Рис.6.11. Установка вакуум-градиент терапии: 1 – форвакуумный насос, 2 - банки.
|
Дата добавления: 2014-01-06; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!