
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные эффекты заместителей
|
|
|
|
Взаимное влияние атомов в органических молекулах
.
азывается П-избыточной системмочной системмойее электроотрицательному атому азота. Органическая химия - это химия соединений углерода, которых в настоящее время насчитывается около 7 млн. В молекулах органических соединений имеются ковалентные  - и П-связи, которые могут быть полярными и неполярными.
- и П-связи, которые могут быть полярными и неполярными.
Неполярные ковалентные возникают между атомами с одинаковыми величинами электроотрицательности, например: в пропане СН3-СН2-СН3. В молекулах органических соединений атом углерода может быть соединён с атомами: О,N,Cl,Br,F и другими гетероатомами, имеющими более высокое значение электроотрицательности по сравнению с атомами углерода. Это приводит к поляризации ковалентной связи, например: в молекуле 1-хлорпропана (CH3-CH2-CH2-Cl). Гетероатом или заместитель вызывает поляризацию не только "своей"  -связью, но и передаёт своё влияние на соседние
-связью, но и передаёт своё влияние на соседние  -связи проявляя индуктивный эффект:
-связи проявляя индуктивный эффект:
Индуктивный эффект - это передача электронного влияния заместителя по цепи  -связей.
-связей.
Индуктивный эффект обозначается I или знаком " ", причём остриё стрелки направлено в сторону более электроотрицательного элемента. Действие индуктивного эффекта наиболее значительно проявляется на двух ближайших атомах углерода, а через 3-4 связи он затухает. Заместители, смещающие электронную плотность по цепи
", причём остриё стрелки направлено в сторону более электроотрицательного элемента. Действие индуктивного эффекта наиболее значительно проявляется на двух ближайших атомах углерода, а через 3-4 связи он затухает. Заместители, смещающие электронную плотность по цепи  -связей в свою сторону, проявляют отрицательный индуктивный эффект (-I). Это так называемые электроноакцепторные заместители (ЭА-заместители), например: -OH, -NH2, -F, -Cl, -Br и др. Заместители, смещающие электронную плотность от себя, повышая её в цепи, проявляют положительный индуктивный эффект (+I). Это электронно-донорные заместители (ЭД-заместители), например: -CH3, -C2H5, -Na, -K и др. В молекулах органических соединений наряду с индуктивным эффектом заместителей также проявляется мезомерный эффект, который действует в сопряжённых системах.
-связей в свою сторону, проявляют отрицательный индуктивный эффект (-I). Это так называемые электроноакцепторные заместители (ЭА-заместители), например: -OH, -NH2, -F, -Cl, -Br и др. Заместители, смещающие электронную плотность от себя, повышая её в цепи, проявляют положительный индуктивный эффект (+I). Это электронно-донорные заместители (ЭД-заместители), например: -CH3, -C2H5, -Na, -K и др. В молекулах органических соединений наряду с индуктивным эффектом заместителей также проявляется мезомерный эффект, который действует в сопряжённых системах.
Сопряжёнными называются системы с чередующимися простыми и двойными связями (...-С=С-С=С-...), или системы, в которых у соседнего, с двойной связью, гетероатома имеется рz -орбиталь с неподелённой парой электронов.
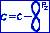
Сопряжённые системы делятся на открытые и замкнутые.
Открытые сопряжённые системы
Примером может служить бутадиен-1,3 СН2=СН-СН=СН2. Рассмотрим на этом примере возникновение П,П-сопряжения.
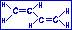
В молекуле бутадиена-1,3 атомы углерода находятся в состоянии sp2-гибридизации.

Атомы углерода, соединяясь между собой  -связями, образуют сигма-скелет молекулы. Рz атомные орбитали каждого атома располагаются перпендикулярно плоскости
-связями, образуют сигма-скелет молекулы. Рz атомные орбитали каждого атома располагаются перпендикулярно плоскости  -скелета и параллельно друг другу, что создаёт условия для их взаимного перекрывания.
-скелета и параллельно друг другу, что создаёт условия для их взаимного перекрывания.

Происходит перекрывание рz-орбиталей атомов С1иС2, С2иС3, С3иС4. В результате него возникает единое сопряженное П-электронное облако, равномерно распределенное (делокализованное) по всей системе. Так возникает П,П-сопряжение при взаимодействии рz-орбиталей и пи-связью.
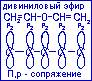
Р,П-сопряжённие возникает при взаимодействии рz-орбитали гетероатома, имеющего не поделённую пару электронов, с П-связью. Рассмотрим на примере дивинилового эфира.
Замкнутые сопряжённые системы
При определённых условиях в циклических молекулах могут возникать замкнутые сопряжённые системы, например: в молекуле бензола С6Н4. В молекуле бензола атомы углерода находятся в состоянии sp2-гибридизации. Система связей С-С и С-Н образует плоский сигма-скелет молекулы (бензольный цикл).

Рz атомные орбитали каждого атома располагаются перпендикулярно плоскости  -скелета и параллельно друг другу, что создаёт условия для их взаимного перекрывания.
-скелета и параллельно друг другу, что создаёт условия для их взаимного перекрывания.
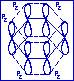
В результате взаимного перекрывания р2-орбиталей атомов углерода возникает единое замкнутое сопряженное р -электронное облако, делокализованное на всех атомах цикла. Такая система называется ароматической.
Хюккель установил критерии ароматичности (1931г):
1.Молекула имеет циклическое строение.
2.Все атомы цикла, находясь в состоянии sp2-гибридизации, соединяясь между собой  -связями, образуют плоский сигма-скелет молекулы. Рz-орбитали каждого атома располагаются перпендикулярно плоскости
-связями, образуют плоский сигма-скелет молекулы. Рz-орбитали каждого атома располагаются перпендикулярно плоскости  -скелета и параллельно друг другу, что создаёт условия для их взаимного перекрывания.
-скелета и параллельно друг другу, что создаёт условия для их взаимного перекрывания.
3.Врезультате взаимного перекрывания взаимного перекрывания рz-орбиталей возникает единое замкнутое сопряжение - П-электоронное облако, делокализованное на всех атомах цикла и содержащее в соответствии с правилом Хюккеля (4n+2) пи-электроны, где n-любое натуральное число (1,2,3...). Для бензола n=1, отсюда ароматическая система бензола содержит (4*1+2)=6 пи-электронов, или ароматический секстет.
Критериям ароматичности также отвечают конденсированные бензоидные соединения, например: нафталин,

природные гетероциклические соединения, например: пиррол,

имидазол.

Рассмотрим критерии ароматичности на примере имидазола,

где 1-пиррольный атом азота, 2-пиридиновый атом азота.
Молекула имидазола отвечает всем трём критериям ароматичности. Для имидазола n=1, следовательно, система имидазола содержит (4*1+2)=6 П-электронов. В ароматический секстет имидазола поставляют по одному электрону три атома углерода и пиридиновый атом азота. Пиррольный атом азота поставляет два электрона (цикл имидазола с П-орбиталями).
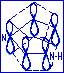
Пиррольный атом азота находится в состоянии sp2-гибридизации. Три гибридные орбитали пиррольного азота участвуют в образовании  -связей с соседними атомами углерода и водорода. Четвёртая негибридная рz-орбиталь участвует в образовании ароматического секстета, поставляя в него неподелённую пару электронов.
-связей с соседними атомами углерода и водорода. Четвёртая негибридная рz-орбиталь участвует в образовании ароматического секстета, поставляя в него неподелённую пару электронов.
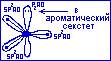
Две гибридные атомные орбитали пиридинового атома азота участвуют в образовании  -связей с соседними атомами углерода. Третья гибридная атомная орбиталь с неподелённой парой электронов лежит в плоскости
-связей с соседними атомами углерода. Третья гибридная атомная орбиталь с неподелённой парой электронов лежит в плоскости  -скелета, обуславливая свойства пиридинового атома азота как основания, т.е. способность присоединять протон Н+.
-скелета, обуславливая свойства пиридинового атома азота как основания, т.е. способность присоединять протон Н+.
Четвёртая негибридная рz-атомная орбиталь участвует в образовании ароматического секстета,
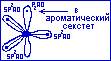
доставляя в него один электрон. В молекулах имидазола 6-электронное П-облако делокализованно на пяти атомах цикла.

Такая система называется П-избыточной системой.
В молекуле другого гетероциклического соединения – пиридина – электронная плотность 6-электронного П-облака смещена к более электроотрицательному атому азота. Такая система называется П-недостаточной.

Образование сопряжённой системы приводит к выравниванию длин связей, равномерному распределению электронной плотности в молекуле, снижению энергетического уровня системы. Всё это способствует стабилизации молекулы. О термодинамической устойчивости сопряжённой системы судят по величине энергии сопряжения, которая рассчитывается по формуле:
 Е=Ен-Ес, где
Е=Ен-Ес, где
 Е – энергия сопряжения
Е – энергия сопряжения
Ен – полная П-электронная энергия несопряжённой системы
Ес – полная П-электронная энергия сопряжённой системы
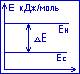
Энергия напряжения равна энергии стабилизации – это та энергия, которая выделяется при образовании сопряжённой системы из несопряжённой системы. В открытых сопряжённых системах чем длиннее цепь сопряжения, тем выше энергия сопряжения и стабильнее система. Замкнутые сопряжённые системы более стабильны, чем открытые.
Мезомерный эффект – это передача электронного влияния заместителя по системе сопряжённых связей в сопряжённой системе. Мезомерный эффект обозначается М или графически стрелкой, начало которой указывает какие р- или П-электроны смещаются, а конец – связь или атом, к которому смещается электронная плотность. Мезомерный эффект заместителей проявляется как в открытых так и в замкнутых сопряжённых системах.
Мезомерный эффект в открытых сопряжённых системах
(пентадиен-2,4-аль с эффектами)

Альдегидная группа и другие заместители, содержащие кратные связи, (например: -СООН, -SO3H2, -NO2) вступая в П,П-сопряжение с сопряжённой системой, оттягивают на себя электронную плотность, понижая её в сопряжённой системе. Они проявляют отрицательный мономерный эффект (-М).
В молекуле этого альдегида также проявляется индуктивный эффект заместителя, который направлен к более электроотрицательному атому кислорода.
Для прогнозирования свойств органических соединений необходимо учитывать результирующее влияние электронных эффектов заместителей. Для этого дают характеристику заместителю с учётом проявляемых эффектов.
Для альдегидной группы: -CHO (-I,-M,ЭА). Под влиянием ЭА-заместителя в молекуле пентадиен-2,4-аля электронная плотность смещается к заместителю и подвижна в углеродной цепи.
Мезомерный эффект в замкнутой сопряжённой системе
Рассмотрим на примере фенола С6Н5ОН (фенол с эффектами).

Гидроксогруппа –: ОН, -: NH2, и другие заместители, содержащие неподелённую пару электронов у гетероатома, вступая в р,П-сопряжение с сопряжённой системой, поставляют в ней неподелённую пару электронов, повышая в неё электронную плотность. Они проявляют положительный мезомерный эффект (+М). Это ЭД-заместители.
-: ОН (-I,+M; +M>>-I, ЭД)
Под влиянием ЭД-заменителя (гидроксогруппы) в молекуле фенола и положениях 2,4,6 (орто- и пара-) появляются реакционные центры, несущие частично отрицательные заряды – нуклеофильные реакционные центры. Заместитель гидроксогруппа относится к ориентам первого рода, т.к. непроявляет последующее замещение в орто- и пара-положения.
Рассмотрим молекулу бензольной кислоты (бензольная кислота с эффектами).

-СООН (-I,-M; ЭА).
Под влиянием ЭА заместителя в молекуле бензольной кислоты в метаположении проявляются реакционные нуклеофильные центры. Заместитель СООН – группа относится к ориентантам второго рода, т.к. направляет последующие заместители в метаположение.
В молекулах ряда органических соединений индуктивный и мезомерный эффекты заместителей действуют одновременно. При этом они могут быть либо однонаправленными, либо противоположно направленными. В большинстве случаев мезомерный эффект преобладает над индуктивным. У галогенов преобладающим является индуктивный эффект. Учитывая перераспределение электронной плотности, происходящее в молекулах органических соединений под влиянием электронных эффектов заместителей, могут прогнозироваться свойства органических соединений.
Стереоизомерия
Изомерия – это явление, при котором вещества имеют одинаковый количественный и качественный состав, молекулярную массу, но отличаются химическим строением или пространственным расположением атомов или групп атомов в молекуле.
Изомерия делится на 2 вида: структурную и пространственную.
Структурная изомерия подразделяется:
1.изомерия углеродной цепи, например: СН3-СН2-СН2-СН3 – бутан и изобутан.

2.изомерия положения кратных связей, например: СН2=СН-СН2-СН2-СН3 – пентен-1и СН3-СН=СН-СН2СН3 – пентен-2.
3.изомерия положения функциональных групп, например: СН3-СН2-СН2-ОН – пропанол-1 и пропанол-2.
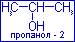
4.межклассовая изомерия. Это вид изомерии, при котором одной и той же эмпирической формуле соответствуют представители разных классов органических соединений, например: эмпирической формуле С2Н6О соответствует СН3-СН2-ОН – этанол и СН3-О-СН3 – диметиловый эфир.
Пространственная изомерия или стереоизомерия – это вид изомерии, при котором изомеры или стереоизомеры отличаются друг от друга пространственным расположением атомов или групп атомов в молекуле.
Стереоизомерия делится на виды:
1.конформационная
2.энантиомерия (оптическая изомерия)
3.диастереомерия (геометрическая изомерия). Они в свою очередь подразделяются:
·  -диастереомерия
-диастереомерия
· П-диастереомерия
Энантиомерия возможна у любых органических соединений, содержащих асимметричный атом углерода. Асимметричным называется атом углерода, соединённый с четырьмя различными группировками, например  -углеродный атом в молекуле молочной кислоты. Асимметричный атом углерода обозначается звёздочкой (*).
-углеродный атом в молекуле молочной кислоты. Асимметричный атом углерода обозначается звёздочкой (*).
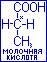
Молекулы веществ, содержащих асимметричный атом углерода, называются хиральными, а асимметричный атом углерода называется хиральным центром.
Энантиомерия – это вид изомерии, при котором стереоизомеры, называемые энантиомерами относятся между собой, как предмет и несовместимое с ним зеркальное изображение.
Например: пара энантиомеров молочной кислоты.

Для обозначения степеней конфигурации энантиомеров вводится понятие о D и L формах, т.е. устанавливают принадлежность каждого энантиомера к определённому D и L стехиометрическому ряду.
В D-формах заместитель, соединённый с хиральным центром, записывается справа по отношению к углеродной цепи, а в L-форме слева по отношению к углеродной цепи.
Энантиомеры обладают оптической активностью, они способны вращать плоскость поляризации света. Оптическая активность энантиомеров определяется на приборе поляриметре, в котором, луч света пройдя через специальную призму, колеблется к одной плоскости, становится плоскополяризованным. Энантиомеры способны отклонять такой луч либо влево, либо вправо.

У энантиомеров угол вращения плоскости поляризации света одинаковый, но направление вращения противоположное. Один энантиомер – левовращающий (знак“-“), а другой – правовращающий (знак”+”), например у молочной кислоты D(-),  =–2,60; L(+),
=–2,60; L(+),  =+2,60 (при 220С в 25% растворе).
=+2,60 (при 220С в 25% растворе).
Знак вращения в плоскости поляризации света не связан с принадлежностью к D или L ряду, он определяется экспериментально. Энантиомеры сходны между собой по физическим и химическим свойствам. Они являются оптическими антидотами. Смесь равных количеств энантиомеров называют рацемат. Он не обладает оптической активностью. Многие биологические соединения содержат 2 и более центра хиральности. Количество стереоизомеров для них рассчитывается по формуле Z=2n, где n- число хиральных центров, например: 2,3,4-тригидроксобутаналь,

n=2, Z=22=4, следовательно этот альдегид образует 4 стереоизомера.
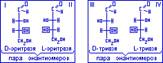
Пара 1и3, 1и4, 2и3, 2и4 – не являются энантиомерами. У них проявляется другой вид стереоизомерии – диастереоизомерия. Диастереоизомеры – изомеры, которые не являются энантиомерами.
У вышеперечисленных пар стереоизомеров проявляется  -диастереомерия, т.к. заменители соединены с хиральными центрами
-диастереомерия, т.к. заменители соединены с хиральными центрами  -связями. Стереоизомер, у которого заместители, соединённые с хиральными центрами, располагаются по одну сторону от углеродной цепи, называется эритроформа, а по разные стороны – треоформа.
-связями. Стереоизомер, у которого заместители, соединённые с хиральными центрами, располагаются по одну сторону от углеродной цепи, называется эритроформа, а по разные стороны – треоформа.
У  -диастереомеров конфигурация одного хирального центра одинаковая, а по другую сторону – противоположная. Пара
-диастереомеров конфигурация одного хирального центра одинаковая, а по другую сторону – противоположная. Пара  -диастереомеров (эритроформа, треоформа).
-диастереомеров (эритроформа, треоформа).

Понятие энантиомерии и  -диастереомерии взаимоисключающие. Если пара стереоизомера является энантиомерами, то они не будут
-диастереомерии взаимоисключающие. Если пара стереоизомера является энантиомерами, то они не будут  -диастереомерами и наоборот.
-диастереомерами и наоборот.
П-диастереомерия – это вид стереоизомерии, при котором стереоизомеры отличаются друг от друга пространственным расположением одинаковых заместителей относительно плоскости П-связи, например: (бутеидиновая кислота, её цис- и трансизомеры).
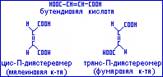
Транс-П-диастереомеры более стабильны и поэтому более распространены в природе. В частности фумаровая кислота является в организме промежуточным продуктом обмена углеводов в анаэробных условиях.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 4791; Нарушение авторских прав?; Мы поможем в написании вашей работы!