
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основные реакции. Алкали- и ацидометрия
|
|
|
|
Теоретические основытитриметрического анализа
ТИТРИМЕТРИЯ
Химический эквивалент – реальная или условная частица вещества, которая в данной реакции реагирует с одним атомом или ионом водорода, или одним электроном.
Закон эквивалентов – вещества вступают в химические реакции и образуются в результате химических реакций в количествах, пропорциональных их эквивалентам.
c (1/z 1 X1)V1 = c (1/z 2 X2)V2
Закон эквивалентов широко используется для количественных расчетов, необходимых при проведении химических реакций.
Титрование – добавление небольших порций раствора одного вещества к известному объему раствора второго вещества.
Анализируемый раствор – раствор, содержащий вещество неизвестной концентрации.
Титрант или рабочий раствор – раствор, содержащий реагент с точно известной концентрацией.
Точка эквивалентности – момент, когда количество вещества эквивалента в добавленном растворе титранта становится равным количеству анализируемого вещества.
Классификация методов т итриметрического анализа
В зависимости от характера химической реакции, лежащих в их основе. Используют основные типы химических реакций:
1. ОВР (реакции с переносом электронов)
2. Кислотно-основные (реакции с переносом протона)
3. Осаждения
4. Комплексообразования
Этим реакциям соответствуют методы:
1 Оксидиметрия (редоксометрия)
2. Ацидометрия и Алкалиметрия
3. Аргентометрия и меркурометрия
4. Комплексометрия и комплексонометрия.
По способу проведения анализа различают:
Прямое титрование – к раствору определяемого вещества непосредственно добавляют титрант. Для определения кислоты необходим рабочий раствор щелочи.
Обратное титрование – определяемое вещество сначало реагирует с точно известным количеством реагента, взятого в избытке. Непрореагировавший избыток титруют рабочим раствором, затем рассчитывают количество реагента, вступившего в реакцию с определяемым веществом.
Метод замещения – проведение реакции с каким -либо реагентом и титрование одного их продуктов этой реакции. В этом случае определяемое вещество замещается продуктом реакции.
В основе многих методов титриметрического анализа лежат реакции ионного обмена. К их числу относятся кислотно-основные реакции нейтрализации, с помощью которых определяет кислоты (алкалиметрия) и основания (ацидометрия).
Точка эквивалентности в методах ацидометрии и алкалиметрии определяется по изменению рН раствора. В титриметрическом анализе для определения точки эквивалентности чаще всего применяют кислотно-основные индикаторы – вещества, которые меняют окраску в зависимости от рН раствора.
Индикаторы представляют собой сложные органические вещества со слабыми кислотными или основными свойствами. Известны одноцветные и двуцветные индикаторы. У одноцветных одна из форм бесцветна. Например, фенолфталеин бесцветный в кислой и нейтральной среде, и малиновый в щелочной среде. К двуцветным относится метиловый оранжевый – в кислой среде розовой окраски, в нейтральной и щелочной желтый.
Титрование различных кислот и оснований должно проводиться до определенных значений рН раствора (показатель титрования рКа должен быть близок к рН в точке эквивалентности).
Кривая титрования – график зависимости рН от объема добавленного рабочего раствора.
В ацидометрии в качестве титранта обычно используют 0,1 М раствор НСl, в алкилиметрии – 0,1 М раствор NaOH.
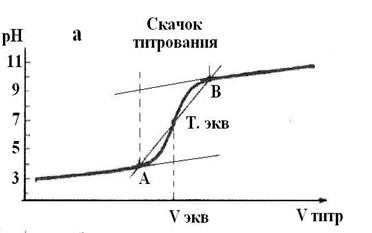
Рис. 1. Кривая титрования.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2084; Нарушение авторских прав?; Мы поможем в написании вашей работы!