
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хлорсеребряный электрод
|
|
|
|
Водородный электрод
Измерение рН
Важнейшей задачей потенциометрии является измерение рН водных растворов. Ясно, что для этой цели в принципе подходит любой электрод, потенциал которого зависит от концентрации (активности) ионов водорода. Можно использовать, например, водородный электрод, стеклянный электрод
Представляет собой платиновую пластину, покрытую платиновой чернью (рыхлой платиной) и опущенную в раствор кислоты, в которой активность ионов водорода равна 1 моль/л и через который все время пропускается чистый газообразный водород под давлением 1 атм (101, 3 кПа).
Условное обозначение Н+ | ½ Н2, Pt
На водородном электроде протекают обратимые процессы
Н2 «2H «2 Н+ + 2 ē
Потенциал стандартного водородного электрода принят за нуль при любой температуре:
j0 (Н+ | ½ Н2) = 0 В.
Водородный электрод не очень удобен в работе, но важен в термодинамическом отношении, поскольку он служит первичным стандартом, относительно которого определяются потенциалы других электродов. На практике в качестве электрода сравнения используют хлорсеребряный электрод.
Состоит из серебряной проволоки, покрытой слоем малорастворимой соли AgCl, опущенной в насыщенный раствор КСl и солевого мостика соединяющего этот раствор с исследуемым раствором.
Электрохимическая цепь хлорсеребряного электрода записывается так:
Ag | AgCl, КСl (нас.)
В хлорсеребряном электроде на межфазной границе протекает реакция:
AgCl (т) + ē «Ag (т) + Cl–
Т.к. активность твердых веществ AgCl и Ag постоянна, то потенциал хлорсеребряного электрода зависит только от активности ионов хлора в растворе.
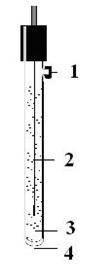
1 – отверстие для заливки раствора электролита
2 – серебряная проволочка, покрытая слоем AgCl
3 – раствор KCl
4 – капилляр
Рис. 3. Устройство хлорсеребряного электрода сравнения.
Потенциал хлорсеребряного электрода постоянен, легко воспроизводим и практически не зависит от протекания побочных реакций.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 5192; Нарушение авторских прав?; Мы поможем в написании вашей работы!