
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрия
|
|
|
|
Потенциометрия – это электрохимический метод анализа, позволяющий определять активность (концентрации) ионов на основании измерения ЭДС гальванической цепи, состоящей из электрода сравнения и электрода определения, опущенных в исследуемый раствор.
ЭЛЕКТРОД - устройство для осуществления полуреакции, состоящее из проводников разного рода (1 и 2 рода).
Проводник 1 рода обладает электронной проводимостью (например, металлы).
Проводник 2 рода обладает ионной проводимостью (растворы и расплавы электролитов).
Электрод сравнения – электрод, потенциал которого практически постоянен, легко воспроизводим и не зависит от протекания побочных реакций.
Общепринятым электродом сравнения является стандартный водородный электрод, потенциал которого принят за ноль при любой температуре. Этот электрод сравнения неудобен в работе, поэтому на практике обычно используют хлорсеребряный электрод.
Электрод определения – электрод, потенциал которого зависит от активности (концентрации) анализируемых ионов и практически не зависит от содержания других ионов в растворе.
Электродами определения являются ионоселективные электроды, среди которых наибольшее применение находят стеклянные электроды.
Электродный потенциал возникает на границе металл-раствор в результате протекания ОВР на межфазной границе, сопровождаемых переходом катионов металла через нее. Значение электродного потенциала численно равно ЭДС гальванической цепи, составленной из стандартного водородного электрода и электрода, потенциал которого подлежит определению.
Гальванический элемент, т.е. химический источник тока (ХИТ) – это устройство для получения электрической работы путем осуществления ОВ-реакции в результате внешнего переноса электронов.
Пример. В ХИТе Даниэля - Якоби пластина Zn погружена в раствор соли ZnSO4, пластина Сu - в раствор CuSO4. Растворы имеют между собой жидкостное соединение через солевой мостик или электролитический ключ, представляющий собой стеклянную трубку, заполненную насыщенным раствором KCl (рис. 1).
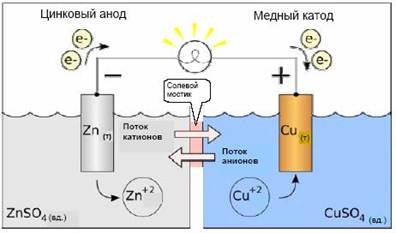
Рис. 2. Гальванический элемент Даниэля – Якоби
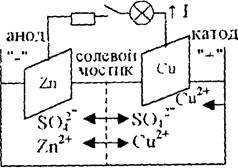
Рис. 5.2. Элемент Даниэля – Якоби. Схема ХИТ.
Электроны по внешней цепи будут переходить от Zn-пластины к Сu-пластине. Ионы (катионы) будут переходить по внутренней цепи в том же направлении. Во внешней цепи прибор покажет ток I.
Ток - направленное движение заряженных частиц электронов и ионов.
Направление тока определяют по направлению перемещения положительных зарядов (обратное направление - движение электронов).
Сu-электрод - катод (заряжен положительно, находится справа). Катодный процесс - процесс восстановления.
Zn - электрод - анод (заряжен отрицательно, находится слева). Анодный процесс - процесс окисления.
Цинковому электроду (электроду Zn2+|Zn) отвечает электродная реакция
Zn2+ + 2e–→ Zn,
а медному электроду (электроду Cu2+|Cu) – электродная реакция
Cu2+ + 2e–→ Cu.
Условная запись электродов Даниэля - Якоби
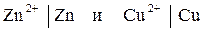
Сочетание разных электродов образует ХИТ. В случае элемента Даниэля-Якоби записывают
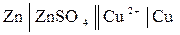
р-р р-р
Двойная черта - это электродный мостик. Поэтому можно записать так:
Zn│ ZnSO4║ KCl ║ CuSO4 │ Cu
Слева в записи находится более отрицательный электрод.
Итак, при протекании химической реакции Zn 0 + Cu 2+ =Zn 2++ Cu 0 в данном ХИТе между электродами возникает разность потенциалов
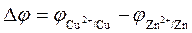
а в цепи при ее замыкании - электрический ток. Источник тока совершает работу: во внешней цепи перенос электронов, во внутренней - перенос ионов.
Уравнение Нернста для процесса в элементе Даниэля – Якоби: 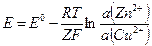
где Z – число электронов, переносимое при протекании одного акта реакции (I), а E0 (= 0,916 В) – разность стандартных электродных потенциалов.
Уравнение Нернста можно применить не только к гальваническому элементу, но и к составляющим его электродам.
Уравнение Нернста для цинкового и медного электродов может быть записано соответственно как
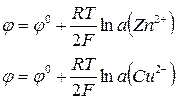
Стандартные электродные потенциалы, приведенные в справочниках.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1341; Нарушение авторских прав?; Мы поможем в написании вашей работы!