
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика
|
|
|
|
ЛАБОРАТОРНЫЕ РАБОТЫ.
Работа 1. Информация о курсе. Техника безопасности и правила работы в лаборатории. Погрешности результатов численного эксперимента. Взвешивание. Домашнее задание: [6] - с.6-9.
Работа 2. Определение состава кристаллогидрата. Зачет по технике безопасности.
Домашнее задание: [6] - с.13-14; [9] - с.4-6, в.1-6.
Работа 3 Определение молярной массы углекислого газа.
Домашнее задание: [6] - с.28-32; [9] - с.б-8, в.1-6.
Работа 4. Приготовление раствора заданной концентрации.
Домашнее задание: [6] - с.17-21, 243; расчеты по работе.
Работа 5. 1-я рубежная контрольная работа.
Работа 6. Определение концентрации раствора титрованием.
Домашнее задание: [6] - с.21-25; [9] - с.12-17, в.1-6.
Работа 7. Приготовление раствора заданной концентрации и титрование.
Домашнее задание: расчеты по работе.
Работа 8. Изучение окислительно-восстановительных реакций.
Домашнее задание: [6] - с.50-53; [8] - с.24-25, уравнения 1-25.
Работа 9. 2-я рубежная контрольная работа.
Работа 10. Определение молярной массы эквивалента (часть 1).
Домашнее задание: [6] - с.36-40, 42-48; [8] - с.24-25, уравнения 26-50.
Работа 11. Определение молярной массы эквивалента (часть 2).
Домашнее задание: [6] - с.36-40, 42-48; [9] - с.8-12, в.1-6.
Работа 12. 3-я рубежная контрольная работа
Работа 13. Получение и свойства комплексных соединений.
Домашнее задание:[6] - с.110-112; [10] - с.35-47, в.1-6, №№ 2-5.
Работа 14. Получение и свойства комплексных соединений (= семинар 17).
Домашнее задание: [4] – с.114-117, [10] - с.35-47, в.1-6, №№ 2-5.
Работа 15. 4-я рубежная контрольная работа
Работа 16. Гидролиз солей.
Домашнее задание: [6] - с.94-98, 101-102; [8] - с.23 - 24, №№ 51, 53, 56, 57, 58, 59 (1,4,9).
Работы 17. Итоговое занятие
Уравнение Аррениуса (точное): k = A·exp(-Ea / RT). Уравнение Вант-Гоффа (грубое): v2 / v1 = (T2-T1) / 10. Экспериментальное определение Ea: по тангенсу угла наклона прямой на графике ln(K) от 1/T: Ea = R * tg(). Скорость параллельной реакции определяется скоростью самой быстрой реакции. Скорость последовательной реакции определяется скоростью самой медленной реакции. Катализ — процесс изменения скорости химической реакции. Не изменяет константу равновесия. DG = const. Катализатор — ускоряющее реакцию вещество, не участвующее в превращениях. Действие катализатора основано на уменьшении энергии активации при образовании активированного комплекса. Гомогенный катализ: катализатор и реагенты находятся в одной фазе. Гетерогенный катализ: катализатор и реагенты находятся в разных фазах; реакция протекает на границе раздела фаз.
Растворы
Раствор — гомогенная (однофазная) система переменного состава двух и более компонентов. XY D (поляризация) D XYD (ионизация) D XYD (сольватация) D X/YD (дисс) D X+YAX (растворённое) + nS D (AX)Sn D A+Sn+ + X-Sn- — процесс сольватации. Способы выражения концентрации. Молярная концентрация [моль/л (М)]: вещества в растворе к объёму раствора. Моляльность [моль/кг]: вещества в растворе к массе растворителя. Молярная доля [%]: количество компонента в растворе к общему количеству компонентов. Массовая доля [%]: масса компонента к массе раствора (сколько граммов на 100 г раствора). Классификация. По числу компонентов: Бинарные (2 компонента) и многокомпонентные. Растворитель — тот, что в избытке. По агрегатному состоянию: Жидкие (водные и неводные) Твёрдые (растворы внедрения и замерзания) Газообразные (равновесные смеси газов в любых соотношениях)
По концентрации: Разбавленные (С £ 0,01) Концентрированные (С = 1 моль/л) Насыщенные (С > 1?) По природе растворённого вещества: Электролиты (сильные (a = 1) и слабые (a < 30%)), a = распавшихся / растворённых. Неэлектролиты. По реальности: Идеальные (нет взаимодействия между AX–S, S–S, AX–AX). AX — растворённое. Реальные. Условие образования идеального раствора: DHид = 0, DS > 0, DV = 0. Растворение — физико-химический, а не механический процесс. Сопровождается тепловым эффектом и резким изменением свойств растворителя. Особенности воды как растворителя. Вода — слабый электролит; КД = (aH+aOH-) / a(H2O). CH+COH- = KД · 55,5 = K. В случае электролитов K= aH+aOH-. pH = -lg (aH+). pH = 7: нейтральная; pH < 7: кислая; pH > 7: щелочная. Сольватация — процесс взаимодействия молекул/ионов растворённого вещества с р-рителем. Процесс сольватации в зависимости от природы растворённого вещества и растворителя может привести к поляризации, ионизации и (в пределе) к диссоциации молекул растворённого вещества. AX + nS D (AX)Sn D A’Sn+ + X-Sn-. Процесс сольватации. Возможен, если DHAX–S > DHAX–AX или DHAX–S > DHS–S. Диссоциация — процесс распада растворённого вещества на свободные ионы под действием сольватации. Возможен, если DHAX–S >> DHAX–AX или DHAX–S >> DHS–S. Ассоциация — взаимодействие молекул/ионов растворённого вещества друг с другом (в чистых жидкостях и концентрированных растворах). Возможен, если DHAX–S < DHAX–AX или DHAX–S < DHS–S. Выводы. Состояние растворённого вещества в растворителе является основным фактором, определяющим свойства системы раствора. Одновременно в растворе могут находиться в равновесии все возможные формы, но возможны предельные случаи, когда в растворе находятся только ионы или только молекулы, если вещество — не электролит.
Растворы
Эбуллиоскопические и криоскопические свойства растворов. i (степеней свободы ТД системы) = число независимых компонентов системы – число фаз + 2. Смотрится по фазовой диаграмме воды. В тройной точке число фаз = 3. Закон Вант-Гоффа. Осмотическое давление P — давление, которое необходимо приложить к раствору с большей концентрацией, чтобы преодолеть транспортировку растворителя. Численно равно давлению, которое создало бы растворённое вещество, находясь в объёме раствора в газообразном состоянии при данной температуре. P = [ i ]CRT. Закон Рауля показывает зависимость давление пара растворителя от C: Для идеального раствора: Pнад раствором = p10 * x1. p10 — давление пара чистого растворителя; x1 — концентрация растворённого вещества. Для реального раствора: Pнад раствором = p10a10, а1 — активность растворённого вещества. Для неэлектролитов: DTкип = КэбСm; DTзам = КкрСm. Сm [моль/кг] — моляльная концентрация. Для реальных растворов: DTкип = iКэбСm; DTзам = iКкрСm. Изотонический коэффициент i = DTзам / кип(теор) / DTзам / кип(эксп) = DP(теор) / DP(эксп). i > 1: электролит; i = 1: неэлектролит; i < 1: ассоциат. Cm(эксп) = DТкип (эксп) / Кэб (в табл). Сm(эксп) > Сm(теор): электролит; Сm(эксп) = Сm(теор): неэлектролит; иначе ассоциат. Короче, для задач формула: i = DTзамерзания / (Ккр * Сm), где Ккр = 1,86. Среднеионный коэффициент активности g± = (g+n+ * g-n-)(n+ * n-). Активность электролита a = ··Cm ·g±. Для задач активность электролита a = g± * * Cm. Ионная сила раствора I = Ѕ åCm(i)zi2. В задачах по I дают g±. ln g± = -A|z+ * z-|*IЅ . Константа А определяется свойствами растворителя. Закон Оствальда: Константа диссоциации КД = C·2 / (1 – ). Для слабых электролитов a = (Кд/C)Ѕ. Также КД рассчитывается через активности по закону действия масс. Закон Оствальда: h = (Kг / C0)Ѕ, h — степень гидролиза, КГ — константа гидролиза.
Дисперсные системы и коллоидные растворы
Дисперсная система — гетерогенная система из двух и более фаз с сильно развитой поверхностью раздела. Дисперсионная среда (ДС) — вещество, образующее в дисперсной системе сплошную фазу. Фаза, распределённая в среде, называется дисперсной фазой (ДФ) (дисперсоидом). Коллоидные системы — системы с размером ДФ порядка 10-7 — 10-9 м. Классифицируются по агрегатному состоянию ДФ и ДС: Лиофильные коллоиды — коллоиды с высоким сродством ДФ и ДС. Нет чёткой границы фаз. Наиболее термодинамически устойчивы. Лиофобные коллоиды — с малым сродством ДФ и ДС. Резкая граница раздела фаз. Менее устойчивы. Адсорбция — процесс поглощения одного вещества поверхностью другого. Правило Пескова-Фаянса: ядро мицеллы адсорбирует из раствора преимущественно те ионы, которые входят в кристаллическую решётку ядра (или изоморфные им) и в растворе находятся в избытке. Заряд гранулы определяется как сумма зарядов потенциалообразующих ионов. Знак заряда гранулы равен знаку заряда потенциалообразующих ионов. Метод получения: 1) измельчение ДФ в ДС, 2) осаждение (конденсация) в результате обменных реакций, где выделяются труднорастворимые продукты. Пример образования мицеллы: 1) AgNO3 + KI " AgI$ + KNO3 (получение частиц ДФ размером 10-7 — 10-9 м) 2) mAgI$ (ДФ) + nAgNO3 (ДС) " {m[AgI]nAg+xNO3–}(n-x)+ (n-x)NO3–. Всё — мицелла, m[AgI] — ядро; nAg+xNO3– — адсорбционный слой, {m[AgI]nAg+xNO3–}(n-x)+ — гранула,
(n-x)NO3– — диффузионный слой. Устойчивость коллоидных систем — способность сохранять присущую им степень дисперсности. Агрегативная связана с наличием заряда одного знака у гранулы, что приводит к отталкиванию частиц и предотвращает их слипание. Кинетическая связана с постоянным броуновским движением частиц. Коагуляция — процесс слипания частиц. После коагуляции снижается устойчивость. Можно устроить коагуляцию, подействовав электролитом. Седиментация (осаждение) — выделение ДФ в виде осадка. Порог коагуляции (Спор) — наименьшая концентрация электролита, вызывающая коагуляцию. Cпор» (Cэл * Vэл)/(Vзоля + Vэл); Cпор» 1/z6, z — заряд коагулирующего иона. При коагуляции мицелл лиофильного коллоида происходит образование геля. Пример коагуляции:
 .
. 
Оптические свойства коллоидов: Эффект Тиндаля (конус) позволяет доказать наличие коллоида. Электрические свойства коллоидов обусловлены наличием заряда у гранулы. Электрофорез — направленное перемещение частиц в постоянном электрическом поле. Электроосмос — перемещение ДС через полупроницаемую перегородку в постоянном электрическом поле.
Кислотно-основные системы
Все химические системы по характеру протекающих в них реакций можно отнести либо к кислотно-основным, либо к окислительно-восстановительным. Теория Аррениуса: В чистом виде кислоты являются неэлектролитами. Кислоты становятся электролитами в воде. Водные растворы кислот изменяют окраску индикаторов. Водные растворы кислот вступают в следующие реакции: K2O + 2HCl " 2KCl + H2O Na + H2Br " H2# + 2NaBr (с активными металлами образуются соль и водород) Na2CO3 + HCl " H2CO3 + Na2SO4 (с солями слабых кислот образуется слабая кислота) Основание — вещество, вступающее с кислотами в реакцию нейтрализации. Не объясняет ряд реакций (органические, аммиак). Теория Бренстеда-Лоури (протонная): Кислота — вещество, состоящее из молекул или ионов, являющихся донором протонов. Основание — вещество, состоящее из молекул или ионов, являющихся акцептором протонов. HCl (кислота) + H2O (основание) ® H3O+ (кислота) + Cl- (основание) Чем выше сродство к протону, тем сильнее основные свойства вещества. Самое высокое сродство у аммиака.
Протофильные вещества — с высоким сродством к протону. Протогенные вещества — с низким родством к протону (HF). Амфипротонные вещества — H2O, C2H5OH. HF (кислота) + C2H5OH (основание) D + C2H5OH2 – (кислота) + F – (основание) Теория Льюиса (электронная): Кислота — вещество, принимающее электронные пары. Основание — вещество, отдающее электронные пары для образования химических связей. Основной механизм кислотно-основного взаимодействия — образование донорно-акцепторных связей. Участие протона не обязательно! (CH3)3N + BF3 D (CH3)N: BF3. Реакция комплексообразования — кислотно-основное взаимодействие, в котором центральный атом – кислота Льюиса, а лиганды – основания Льюиса. Th4+ (кислота Льюиса) + 4CO32- (основание Льюиса) D [Th(CO3)4]4-. (CO3)4 — лиганды.
Комплексные соединения
Комплексные соединения образуются в избытке электролита за счёт донорно-акцепторного взаимодействия. Условие образования комплекса: 1) избыток электролита, 2) возможность образовывать донорно-акцепторные связи между взаимодействующими молекулами, 3) наличие свободных орбиталей. Комплексообразование — процесс образования за счёт донорно-акцепторного взаимодействия устойчивого соединения, называемого комплексом. Типичные комплексообразователи и лиганды. Типичные комплексообразователи: d- и f-металлы: Cu, Fe2+, Fe3+, Co, Ni, Pf, Au, Ag, Eu, Ce, Th, U. Типичные лиганды: молекулы с неподелённой электронной парой: анионы, любые галогены: F –, OH –,CO32-, CN –, NO32-, …. Координационное число — число лиганд в комплексе. Часто бывает 4, 6, 8, 2. Вообще 2,..., 12. Дентатность — число донорных атомов лиганд, непосредственно связанных с комплексообразователем. Строение комплексного соединения. K2[Cd(CN)4]. Внутренняя сфера — Cd(CN)4. Называется комплексом. Комплексообразователь — Cd2+. Лиганды — CN –. Заряд: -2. Заряд комплекса равен суммарному заряду внешней сферы с противоположным знаком. Взаимосвязь строения комплексов и гибридизации орбиталей комплексообразователей. Гибридные орбитали возникают в результате влияния лигандов на комплексообразователь и стремления к максимальному выигрышу энергии. Между КЧ КО, типом гибридизации и геометрией существует связь:Энергетический ряд лигандов:I < Cl < F < OH < C2O4 = H2O < NH3 < SO3 < NO2. [Co(H2O)6]2+: Co2+ [ ] Тип гибридизации: sp3d2 — октаэдрический. [Co(CN)6]4–: Co2+ [ ] Тип гибридизации: sp3d2 — октаэдрический. Комплексные соединения, имеющие в своём составе внутреннюю и внешнюю сферы, диссоциируют в водных растворах практически полностью, т. е. являются сильными электролитами. Причём диссоциация комплексных ионов идёт ступенчато (как диссоциация слабых электролитов). Для каждой ступени константа равновесия называется константой нестойкости. Общая константа нестойкости равна произведению ступенчатых констант нестойкости — характеристика прочности комплекса. Чем меньше Кн, тем прочнее комплекс. Разрушение комплексных соединений. Если ПК ионов комплексообразователя и осадителя больше, чем ПР осадка, то комплекс разрушается и выпадет осадок. Приближённая оценка: сравнение констант нестойкости комплекса и ПР предполагаемого осадка. Если КН << ПР, то разрушение не произойдёт. Классификация комплексных соединений: Содержащие молекулярные монодентатные лиганды: амино- и аквакомплексы. Бидентатные: [Th(C2O4)4]4- Внутрикомплексные: диглиценат меди Двойные соли не являются комплексами: KAl(SO4)2, NH4Fe(SO4)2. Соединения, сложные по своему составу, строение которых может быть объяснено с точки зрения двойных связей.
Электрохимические процессы
Окислительно-восстановительные реакции состоят из процессов окисления и восстановления. Окисление/восстановление — отдача/принятие электронов веществом. Окислитель/восстановитель — вещество, отдающее/принимающее электроны в реакции. Степень окисления — число электронов, смещённых от атома данного элемента или к атому данного элемента в соединении. Химический способ осуществления ОВР — непосредственная передача электронов от восстановителя к окислителю. В этом случае DG < 0. Электрохимический способ осуществления ОВР. Отличается тем, что полуреакции пространственно разделены, т. е. хаотический перенос электронов преобразуется в направленный процесс переноса электронов от восстановителя через внешнюю цепь к окислителю и, как следствие этого, превращение химической энергии в электрическую. Электрохимические процессы протекают в окислительно-восстановительных (ОВ) системах, где происходят процессы превращения химической энергии в электрическую и наоборот. В основе всех ЭХП лежат процессы переноса заряженных частиц из одной фазы в другую, сопровождающиеся образованием ДЭС и разности потенциалов (электролит/электрод: электродного (ж/тв), контактного (тв/тв) и диффузионного (ж/ж)) на границе раздела фаз. Двойной электрический слой (ДЭС) — тонкий поверхностный слой из пространственно разделённых зарядов противоположных знаков, образующихся на границе раздела фаз. ДЭС образуется в результате: 1) Обмена ионами между металлом и раствором электролита. оложительные ионы из металла отрываются водой и переносятся в раствор. 2) Адсорбция ионов на поверхности электрода. 3) Выход электронов из кристаллической решётки электрода. Основные элементы электрохимической системы: Электроды (металлы, полупроводники) Электролиты с ионной проводимостью (раствор, расплав, твёрдое вещество) Граница раздела фаз (электролит | электрод).
Гальванические элементы
Проводник 1 рода — имеющий электронную проводимость. Проводник 2 рода — имеющий ионную проводимость (раствор). Электрод — проводник 1 рода, находящийся в контакте с ионным проводником. Электрод 1 рода — металл/неметалл, погружённый в раствор, содержащий ионы данного еталла/неметалла. Электрод 2 рода — металл, покрытый слоем труднорастворимой соли и погружённый в электролит, содержащий ионы этой соли. Гальванический элемент — электрохимическая система, в которой химическая энергия преобразуется в электрическую. Состоит из двух электродов, соединённых проводниками первого или второго рода в замкнутую цепь. Электродный потенциал — относительный равновесный электродный потенциал, измеренный по отношению к условной точке отсчёта ( одородного электрода = 0). 0 — относительный стандартный электродный потенциал по водородной шкале. Уравнение Нернста: 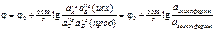 . ЭДС гальванического элемента E = jкатода – jанода = E0 + (1/z) * 0,059 * lg (aкатода / aанода). Связь ЭДС и энергии Гиббса: DG = -nFE. Отсюда можно делать выводы относительно направления протекания реакций ОВР: DG < 0: прямая реакция возможна. Правила записи гальванических элементов. В ГЭ ЭДС всегда > 0.
. ЭДС гальванического элемента E = jкатода – jанода = E0 + (1/z) * 0,059 * lg (aкатода / aанода). Связь ЭДС и энергии Гиббса: DG = -nFE. Отсюда можно делать выводы относительно направления протекания реакций ОВР: DG < 0: прямая реакция возможна. Правила записи гальванических элементов. В ГЭ ЭДС всегда > 0.
Слева записывают электрод с меньшим потенциалом. Zn- (анод) | ZnSO4 || CuSO4 | Cu (катод) Типы гальванических элементов: Стандартные: Водородный электрод. j(H+/H2) = 0. Всегда. Кислородный электрод. OH- | O2, Pt. 4OH- – 4e- D O2 + 2H2O. j = 1,277 – 0,059pH. Обратимые: ГЭ, в которых прямая токообразующая реакция и обратная (потребление электрической энергии) представляют собой одну и ту же взаимообратимую реакцию. Zn | ZnSO4 Электродные потенциалы не зависят от механизма образования двойного электрического слоя, а зависит от природы электрода и активности ионов, участвующих в электродной реакции. j0 — справочная величина (по водородной шкале). Чем больше j$0$, тем сильнее окислительные свойства. Внимание! Если один из электродов —стандартный водородный, то он записывается на первом месте: Pt, H2 | H+ || Cu2+ | Cu0, E > 0. Pt, H2 | H+ || Zn2+ | Zn0, E < 0.
Электролиз
Электролиз — процесс синтеза или разложения веществ с помощью электрического тока, О-В процесс, полуреакции которого осуществляются на отдельных электродах. В процессе электролиза катионы движутся к катоду, анионы — к аноду и на нём окисляются. Отличие от ГЭ: в ГЭ протекает самопроизвольный ОВ процесс, а при электролизе происходит процесс потребления электрической энергии. Перенапряжение (h) — величина дополнительного потенциала (напряжения) по сравнению с равновесным, необходимая для протекания электродного процесса с определённой скоростью. Для того, чтобы пошёл электролиз, величина приложенного напряжения должна превышать стандартную ЭДС. При равновесном j в системе имеет место равновесие, электролиз не идёт. Электролиз возможен при условии, что Uэлектролиза = Eравновесн + h. При электролизе перенапряжение представляет собой сумму h катода и анода. hкат смещает равновесный электродный потенциал в отрицательную сторону. hанодн смещает равновесный электродный потенциал в положительную сторону. Скорость электролиза — величина тока через единицу поверхности электрода D [А/см2]. Факторы, влияющие на h: природа, материал электрода, концентрация электролита, v ~ D. Правило электролиза: при конкурирующих процессах на катоде в первую очередь выделяется тот электролит, потенциал которого больше, а на аноде — меньше. При электролизе растворов на катоде в первую очередь разряжаются те ионы, потенциал которых с учётом h больше, а на аноде — меньше. Если анод – металл, то среди конкурирующих процессов необходимо учесть возможность растворения самого анода. При электролизе водных растворов галогенов на аноде выделяются в свободном виде галоген, а не кислород, т. к. их h << h(O2). j разряда кислородосодержащих ионов с учётом перенапряжения больше 2,5 В, поэтому их водных растворов они не разряжаются на катоде. Большие величины перенапряжения выделения водорода при разряде на некоторых активных металлах используются для получения этих металлов из водных растворов. Пример: Электролит: KI, pH = 7. Катод: Cu, h = (H2/Cu) = 0,7 V Анод: Cu, h = (H2/Cu) = 0,7 V Характеристика электролита: KI ® K+ + I-. H2O D H+ + OH-, pH = 7. Вероятные процессы на катоде и аноде: На катоде: 1)K+ + e- ® K0, j = 0j(K0/K) - h(K/K0) = –2,7 – 0 = –2,7 V. 2) 2H2O + 2e- ® H2# + 2OH- (из стр. 100). j = j0(H2/H+) - h(H2/C?) = -0,4 V. j1 < j2 Þ На катоде в первую очередь пойдёт процесс 2. На аноде: 3) 2I- – 2e ® I2, j = j0(I2/I) + h(I2) = 0,54. Пойдёт этот. 4) 2H20 – 4e D O2 + 2H2, j = j0(O2/O-2) + h(O2/Cu) = 0,814 + 1,1 = 1,914 V. Уравнение электролиза (2) + (3): 2H2O + 2e + 2I- - 2e ® электролиз ® H2# + 2OH- + I2.
Коррозия металлов
Коррозия — разрушение металла (редко материала) в результате химического (электрохимического) воздействия. Химическая коррозия — разрушение металла под действием окислителей окружающей среды, если среда не электропроводна. Скорости химической коррозии зависит от скорости диффузии газа через поверхность плёнки к металлу, а также от встречной диффузии металла. Электрохимическая коррозия — процессы окисления и восстановления пространственно разделены. Возникает в химических средах с ионной проводимостью при наличии контакта разнородных металлов за счёт образования гальванических микроэлементов. При коррозии происходит анодное растворение металла за счёт катодного восстановления окислителя среды H+ (pH < 7) и O2?(pH ³ 7) При коррозии скорость более активного металла возрастает, а менее активного — убывает. Процесс коррозии пойдёт амопроизвольно, если jок > jаосст. Методы защиты о коррозии: Покрытие металлом: более активный металл является защитным для основного независимо от дефектов. Покрытие железа цинком. Zn – 2e ® Zn2+; 2H+ + 2e ® H2 Покрытие неметаллом: только при отсутствии дефектов.
План характеристики свойств элемента
Анализ структуры группы. Электронная формула элемента и его аналогов: Анализ свойств элементов подгруппы в зависимости от электронного строения. Изменение радиуса в атоме и у элементов подгруппы.
Изменение электроотрицательности j0, характеристика О-В свойств (если металл — активность, неметалл — характеристика О-И свойств в различных степенях окисления). Свойства соединений:
Основные степени окисления (из электронного строения) Основные соединения в этих степенях окисления и их растворимость Растворимость солей Электролитическая диссоциация кислот/оснований
Гидролиз солей Возможность участия в ОВР (указать степени окисления для окислителя и восстановителя) Возможность комплексообразования Применение, получение, особенности элемента.
Водород
Водород — простейший элемент в ПСХЭ. Его строение — 1H 1S1. Особенности электронного строения: единственный электрон атома находится в сфере действия ядра. H+ — элементарная частица (протон) Количество соединений водорода — больше миллиона, основное соединение: H2O. 411H ® 24He + 2e+ + 2n + 26,7 МэВ. Термоядерная реакция. 2H ® H2 (#$) — параводород (75%), Ткип = 20,41. 2H ® H2 (##) — ортоводород (25%), Ткип = 20,49. Изотопы водорода: Протий 12H — 99,985% Дейтерий 12H — 0,015% Тритий 12H — 0%. Искусственный элемент, tЅ. D2O — мёртвая вода. Химические свойства: H — H. Есв = 431 КДж/моль. Прочная, при н. у. взаимодействует только с фтором. H2 + F2 ® 2HF. В атомарном состоянии водород чрезвычайно активен. Окислитель при взаимодействии с активными металлами. 2Na + H2 ® 2NaH-1 H2 + 2e D 2H- Na0 -1e D Na+. Восстановитель (большинство реакций). При нагревании взаимодействует со всеми неметаллами. H2) -2e D 2H+. Свойства соединений водорода. Ионные гидриды (s-металлы) — NaH2, LiH. Соединения имеют ионный характер. Под действием молекул воды полностью гидрализуются. CaH2 + H2O ® Ca(OH)2 + H2#. Металлоподобные гидриды (d- и f- металлы). Обычно не имеют стехиометрического состава и имеют нестехиометрические индексы (ZrH1,97). Не гидрализуются. Ковалентные (неполярные) гидриды. Взаимодействуют с неметаллами. H2S, AsH3, PH3, SiH4, CH4. PH3 + H20 ® HPO2 + H2#. Получение водорода. В лабораторных условиях: 1) Zn + HCl ® ZnCl2 + H2#. 2) Гидролиз водных гидридов: NaH + H2O ® H2 ® NaOH. 3) Электролиз H2O ® H2O ® H2 + O2. NaCl + H2O ® H2# + Cl2 + NaOH. Промышленные способы: 2СH4 + O2 ® (t = 900) ® CO + 4H2#. CH4 + O2 + 2H2O ® (t=800) ® CO2# + H2#. Применение: Получение аммиака: N2 + 3H2# D 2NH3. Получение тугоплавких металлов из их оксидов: MexOy + H2 ® Me2 + H2O.
s-элементы первой и второй групп
1) Сходство. S-металлы 1/2 групп имеют на последнем энергетическом уровне 1/2 электрона соответственно. Предыдущий уровень полностью завершён и стабилен, и оказывает экранирующее действие на валентные электроны. В результате этого экранирующего действия S-металлы 1 и 2 групп являются самыми активными металлами (и одновременно восстановителями). Вследствие своей активности s-металлы встречаются только в виде соединений. Начиная с 4 периода начинается нарушение монотонного изменения свойств в результате появления (n-1)d-подуровня и скачкообразные изменения таких свойств, как tпл и др. Особенности свойств лития и бериллия. Li и Be имеют особые свойства (меньшую химическую активность) из-за особого электронного строения (пред. слой из 2 электронов, внешние электроны находятся близко к ядру Þ Be амф. 2) Химические свойства s-металлов. Активные металлы без дополнительного инициирования взаимодействуют со всеми неметаллами с выделением большого количества энергии. С неметаллами: Кислород: 1 гр) 4Na+O2®2Na2O. 2 гр) 2Ba + O2 ® 2Ba2O Li + O2 ® Li2O (менее активен). Образование оксидов характерно только для Li. (K, Rb, Cs) + O2 ® Э2O2 (пероксид), (C, Ba) — пероксид, оксид. (Be, Mg) — только оксид. K + O2 ® K2O4. Суперпероксид. Азот: 1 гр) Na + N2 ® Na3N 2 гр) Mg + N2 ® (t) ® Mg3Nn. Водород: 2Na + H2 ® 2NaH Ca + H2 ® CaH2 CaH2 + H2O ® Ca(OH)2$ + H2. С водой: протекают бурно ® Э(OH) + H2# Цезий и рубидий взрываются.. Me + 2H2O ® 2MeOР + H2#. Me + 2H2O ® Me(OH)2 + H2# (кроме Be, Mg). Be(OH)2 (амф) + 2HCl ® BeCl + 2H2O. Be(OH)2 + 2NaOH ® Na2[Be2+(OH)4]2- + 4H2O. Растворимость солей: Na+ + K3[Sb(OH)6] ® Na3[Sb(OH)6]$ + 3K+. K+ + ClO4 ® KCLO4$ Li+ + (F-, PO43-, CO32-). Нет переменных степеней окисления ни у 1S, ни у 2S элементов Þ нет реакций с изменением степени окисления, но сами металлы являются восстановителями: TiO2 + Ca ® (t) ® Ti$ + 2CaO. И ещё: Na2O2 + CO2 ® Na2CO3 + O2#; Na2O2 + H2O ® NaOH + O2#. Получение: Электролиз: только расплавов (электродный потенциал» -2). 2NaCl ® Na$ + Cl2. Исключение: Be, Mg. Металлотермия: только для Be и Mg. BeO + Mg ® (t) ® Be$ + MgO; BeO + C ® (t) ® Be$ + CO; MgO + C ® Mg$ + CO. Применение:
Li, Be, Mg используются в качестве добавок к редким сплавам и придают им свойство жаропрочности. Используются в атомной области (67Li + 01n ® 13T + 24He). B идёт на производство сплавов в космической технике, используется для инициирования ядерной реакции.
d-элементы первой и второй групп
1) Электронное строение 1 гр) Э [ ] (n-1)d9nS2 2 гр) Э [ ] (n-1)d10nS2. Степень окисления +2. Несмотря на одинаковое строение внешних электронных оболочек, энергия ионизации для d-металлов куда выше, чем для соответствующих s-металлов. Это объясняется проникновением внешних s-электронов под экран (n-1) 10 электронов. Поэтому d-металлы химически гораздо более активны, чем соответствующие s-металлы. В подгруппе с ростом заряда ядра эффект проникновения усиливается, что приводит к ослаблению химической активности металла. Химические свойства. 1 гр) с O2 не взаимодействуют. Только 2Cu + O2 ® (high t) ® 2CuO c H2O не вз 2 гр) Zn + O2 ® ZnO с H2O не взаимодействуют. Zn + H2O ® H2 +Zn(OH)2 Cu + Cl2 ® CuCl2. Кислотно-основные свойства. 1 гр) Cu(OH)2 — основные свойства 2 гр) Zn(OH)2 — амфотерен. Cu(OH)2 + 2HCl ® CuCl2 + H2O. C(OH)2 + NaOH не идёт. Zn(OH)2 + 2HCl ® ZnCl2 + H2O. Zn(OH)2 + NaOH ® Na2ZnO2 + H2O (or ® Na2[Zn(OH)4]. Cd2+, Hg2+ + NaOH не идёт. Комплексообразование. CaSO4 + 4NH4OH ® [Cu(NH3)4] + 4H2O. Cu + 4HCl (конц) ® H[Cu+Cl2] + H2#. Ag+1Cl ® NH4OH ® [Ag(NH3)4]Cl + 2H2O. AuCl3 + HCl ® H[AuCl4]. ZnCl2 + NH4OH ® [Zn(NH3)4]Cl2 + H2O. Окислительно-восстановительные свойства. Cu, Ag, Au + разб не идёт. Сu + H2SO4 ® (O2) ® CuSO4 + H2. Сu + 2H2SO4 (конц) ® CuSO4 + SO2 + 2H2O. Cu + 8HNO3 ® 2NO + 3Cu(NO3)2 + 7H2O. Ag + 2HNO3 (конц) ® NO2 + AgNO3 + H2O. 3HCl + HNO3 ® 2Cl + NOCl + H2O. Царская водка. 1 ст) Au + 3Cl ® AuCl3 AuCl3 + HCl ® H[AuCl4] Au + 3HCl + HNO3 ® H[AuCL4] (раствор) Получение. Электролиз раствора. В лекции нет.
Жёсткость воды
Труднорастворимые SO42- и CO32- 2s элементов приводят к жёсткости воды. Жёсткость воды — наличие в ней солей кальция и магния. Измеряется в [мМоль/л]. Мягкая: < 2; Средняя: 2 — 10; Жёсткая: > 10. Карбонатная: Ca(HCO3); Mg(HCO3)2. Методы устранения жёсткости воды: Кипячение: Ca(HCO3) ® (t) ® CaCO3 (накипь) + H2O + CO2#. Высаливание: CaSO4 + Na2SO3 + CaCO3$ + Na2SO4. Ионный обмен: RSO3H + Ca2+ ® (RSO3)2Ca + 2H+. ROH + SO42- ® R2SO4 + 2OH-.
Третья группа ПСХЭ
Главная подгруппа: p-элементы (B (неме), Al, Ga, In, Tl (ме)). [ ] nS2nP1 Þ +3. Побочная подгруппа: d-элементы (Sc, Y, La. Ac). [ ] (n-1)d1nS2. f-элементы: лантаноиды (Сe — Lu) [ ] 4f1-14 [ ]5d16S2; актиноиды (Th — Lr) [ ] 5f1-14 [ ]6d17S2 Общие свойства элементов III группы. Все элементы 3 группы имеют основную валентность 3 (степень окисления +3), и состав их соединений в этой степени окисления аналогичен: B2O3, In2O3, Y2O3. Все элементы характеризуются металлическими свойствами: Y(OH)3, Eu(OH)3, Al(OH)3, H3BO3. Для оксидов и гидроксидов, как правило, проявляются основные свойства. Все соединения III группы имеют подобные растворимые (хлориды) и нерастворимые (гидроксиды, фториды, карбониды, оксолаты) соединения. Различия между элементами главной и побочной подгрупп. 1) Элементы главной подгруппы имеют иное электронное строение внешнего слоя (p-электроны) Þ их металлы будут менее активными. Наличие одного электрона на p-подуровне ослабляет металлические свойства элементов главной подгруппы. 2) Элементы побочных подгрупп (d- и f-) на внешнем слое имеют nS2 электроны и являются типичными металлами.
d-элементы III группы побочной подгруппы (Sc, Y, La)
Sc, Y, La ® Усиление металлических свойств. Взаимодействие с O2: 4Sс + 3O2 ® 2Sc2O3. Защитная плёнка (и для Y). 4La + 3O2 ® La2O3. Порошкообразный, не защищает. При растворении в воде образуют гидроксиды: Me + 6H2O ® Me(OH)3 + 3H2#. 8Sc + 30HNO3 ® 3NH4NO3 + 8Sc(NO3)3 + 9H2O. Sc0 – 3e D Se3+; N+5 + 8e D N-3. Амфотерность: Y, La, Ac — неамфотерны + NaOH не идёт. 2Sc + 2NaOH + 4H2O ® H2 + 2NaScO2. 2H+ + 2e D H2; Se – 3e D Se3+. Растворимость: Растворимы: Э(NO3)3; Э(SO)3; ЭCl3; ЭBr3. Нерастворимы: Э(OH)3; ЭF3; ЭPO4; Э2(C2O4)3. Комплексообразование: Sc (КЧ = 6); Y (КЧ = 8); La (КЧ = 8/9). Реакции комплексообразования позволяют отделить некоторые элементы от других, неспособных образовывать комплекс в аналогичных условиях: Отделение Sc3+ от других Э3+. Отделение от других трёхвалентных элементов основано на том, что Sc способен образовывать комплекс с ионом F-. ScF3$ + 3NH4F ® (NH4)3[ScF6]3- (раствор). (La/Y)F3 + NH4F3 не идёт. Гидролиз. Э3+ — слабое основание: ЭCl3 + H2# + H2O D Э(OH)CL2 + HCl. ЭÎ{Y, La}. Получение. Термическое разложение: Y2(C2O4)3 ® (t) ® Y2O3 + CO2 + CO3. Y2(CO3)3 ® Y2O3$ ® 3CO2# Металлотермия: кальцийтермия и магнийтермия 2YF3 + 3Ca ® (t) ® 2Y$ + 3CaF2 Y2O3 + Mg ® (t > tплавл) ® 2Y$ + 3MgO Электролиз. Только расплава: LaCl3 ® (t» 850) ® La$ + 3/2 Cl2#.
f-элементы III группы (лантаноиды)
Лантаноиды: Ce — Lu. Заполнение 4f. [ ] 4f1-14 [ ]5d16S2. Степень окисления +3. Аналоги d-эл 3 гр. Особенности свойств лантаноидов. Некоторые лантаноиды имеют переменную степень окисления, что вызвано стремлением их атомов приобрести устойчивую конфигурацию f-подуровня (4f0, 4f7, 4f14).
E(4f)» E(5f) Þ между электронами на этих подуровнях возможен обратный переход с образованием устойчивой электронной конйигурации. Переменную валентность имеют Ce (+3, +4), Eu (+3, +2), Tb (+3, +4), Yb (+2, +3). Эффект лантаноидного сжатия проявляется в том, что в ряду лантаноидов по мере увеличения заряда ядра уменьшается радиус атома. Это связано с тем, что заполняемый подуровень (4f) находится в глубине. Близкие размерные факторы — основа для объёдинения элементов в редкоземельные (РЗЭ): 16 элементов: 14 лантаноидов, Y и La. Химические свойства зависят от строения внешнего энергетического уровня и радиуса атома. Близость атомного радиуса обусловливают аналогичные свойства этих элементов и являются причиной трудности разделения лантаноидов. Редкоземельные элементы. Две группы: цериевая (La, Ce — Cd), иттриевая (Y, Tb — Lu).
Свойства церия
58Ce [ ] 4f1 [ ] 5d16s2. Степень окисления +3, аналог d-элементов III группы. 58Ce [ ] 4f0 [ ] 5d26s2. Степень окисления +4, аналог d-элементов 4 группы (Ti, Zr, Hf). Ce3+ — восстановитель. Ce3+ + окислитель ® Ce4+. 3Ce(OH)3$ + KMnO4 + 2H2O ® (ph > 7) ® 3Ce(OH)4$ + MnO2 + KOH Качественные реакции на ион церия: Ce(OH)4 + H2O2 ® (pH > 7) ® Ce(OH)4$ (жёлт), а затем Ce(OH)4 + H2O ® (pH > 7) ® Ce (OOH)4$ (оранж). Ce(NO3) + 3NH4OH ® Ce(OH)3$ + 3NH4NO3 Ce(OH)4 + H2O2 ® (pH<7) ® O2# + Ce2(SO4)3. ОВР. 2Ce(OH)4 + H2O2 + 3H2SO4 ® (ph = 7) ® Ce2(SO4)3 + O2# + 4H2O. ОВР. Ce2(C2O4)3 + O2 ® (t) ® CeO2 + 6CO2. ОВР. Hard! Ce4+ — окислитель. Ce4+ + восстановитель ® Ce3+. При pH < 7. 2Ce(OH)4 + 8HCl ® Cl2 + 2CeCl3 + 7H2O. 2Ce(SO4)2 + 2KI- ® Ce2(SO4)3 + I2 + K2SO4. Ce+4(SO4)2 + H2O2 ® Ce2+3(SO4)3 + O2 + H2SO4. Кислотно-основные свойства Ce4+. Основные: Ce(OH)4 + H2SO4 ® Ce(SO4)2 + 2H2O. 2Ce(OH)3 + 3H2SO4 ® Ce2(SO4)3 + 3H2O. Кислотные: Ce+4(OH)4 + NaOH ® Na2CeO3 + H2O. Ce(OH)3 + NaOH не идёт. Отделение церия от других редкоземельных элементов. В основе — способность церия обладать степенью окисления +4. Ce(OH)4$ + HCl ® (pH = 1,5) ® 2CeCl3 + Cl2 + 8H2O. Ce(OH)3$ + HCl ® CeCl3 + 3H2O. R(OH)3$ + HCl ® (pH = 6,5) ® RCl3 + 3H2O. Комплексообразование — один из способов отделения. Церий, в отличие от других редкоземельных элементов, в степени окисления +3 способен образовывать комплексы с КЧ = 8 (растворы оксолатов и карбонатов). Ce(C2O4)2$ + (NH4)C2O4 ® (NH4)[Ce+4(C2O4)]4-. Na2/R2/Ce2(C2O4)3$ + (NH4)C2O4 не идёт.
Свойства соединений церия в различных степенях окисления
Свойства соединений церия Ce3+. Ce(NO3)3+3NaOH ® Ce(OH)3¯+3NaNO3; Ce(OH)3¯+3HCl®CeCl3+3H2O;
Ce(OH)3¯+NaOH¹; 2Ce(NO3)3+3(NH4)C2O4®Ce2(C2O4)3¯(бел)+6NH4NO3; Ce(NO3)3+3Na2CO3 ®Ce2(C2O4)3¯(бел)+6NaNO3; Ce(NO3)3+3NaF®CeF3¯(бел)+3NaNO3; Ce(NO3)3+Na3PO4 ®CePO4¯(бел)+3NaNO3; NaBi+5O3¯+6HNO3+2Ce(NO3)3® 2Ce(NO3)4(желт)+Bi+3(NO3)3+NaNO3+3H2O Bi+5+2e®Bi+3 окислитель Eок=1.86 В Ce+3-e®Ce+4 восстановитель Eвос=161 В E = Eок-Eвос = 0,25 В. Св-ва соединений церия Ce 4+. Ce(SO4)2(жёлтый р-р)+4NaOH®Ce(OH)4¯+2Na2SO4; Ce(OH)4+NaOH¹водный р-р; Ce(OH)4+2NaON®t°Na2CeO3+3H2O; Ce(OH)4¯+2H2SO4® Ce(SO4)2+4H2O; 2Ce+4(OH)4+8HCl-1®2Ce+3Cl3+Cl2+8H2O Ce+4+e®Ce+3 окислитель xок=1.61 В 2Cl-1-2e®Cl20 восстановитель xвост=1.36 В; 2Ce(SO4)2+KI®pH<7I2+K2SO4+Ce2(SO4)3 Ce+4+e®Ce+3 окислитель xок=1.61 В 2I--2e®I2 восстановитель xвост=-0.54; 2Ce(SO4)2+H2O2®Ce2(SO4)3+O2+H2SO4 Ce+4+e®Ce+3 окислитель xок=1.61 В 2O-1-2e®O20 восстановитель xвост=1.23 В. Качественные реакции на ионы церия. Ce(NO3)3+3NH4OH® Ce(OH)3¯+3NH4NO3; 2Ce(OH)3+H2O2®Ce(OH)4¯; Ce(OH)4¯+H2O2®Ce(OH)3(OOH)¯+H2O.
Свойства европия.
Электронное строение. Eu [ ] 4f6 [ ] 5d16s2. +3. Аналог R+3 РЗ (4f), некоторых 3d (Sc, La, Y, Ac).
Eu [ ] 4f7 [ ] 5d06s2. +2. (Ca, B). EuSO4$. Окислительно-восстановительные свойства. Eu2+ D Eu3+. Eu2(SO4)3 + Zn ® (pH < 7) ® 2EuSO4$ + ZnSO4. Отделение Eu от других редкоземельных элементов связано с его способностью образовывать труднорастворимый сульфат в двухвалентном состоянии: R2(SO4)3 — раствор. Кислотно-основные свойства европия. Eu(OH)3 + 3HCl ® EuCl3 + 3H2O Eu + 2H2O ® Eu(OH)2 + H2#. Eu(OH)2+H2SO4 ® EuSO4$ + H2O Eu(OH)3/2 + NaOH ¹. CeC + H2O ® Ce(OH)4$ + CH4.
CeC2 + H2O ® Ce(OH)4$ + C2H4. EuC2 + H2O ® Ce(OH)2$ + Eu2C2. CaC2 + H2O ® Ca(OH)2 + C2H2.
Методы получения лантаноидов
Выделение лантаноидов в чистом виде с помощью электролиза невозможно. Идёт электролиз воды. оказательство: LaCl3 D La3+ + 3Cl-. H2O D H+ + OH-. На катоде: La3+ + 3e " La0 j1 = -2,522 2H2O + 2e D H2# + 2OH– j2 = -0,413. Идёт. На аноде: 2Cl– -2e " Cl20 j3 = 1,36. На самом деле идёт этот. 2H2O - 4e D O2# + 4H+ j2 = 0,814 + h. Итого: 2Cl- + 2H2O " H2# + 2OH- + Cl2#. 2LaCl3 + 6H2O " 3H2# + 3Cl2# + 2La(OH)3$. Þ Þ Выделение лантаноидов в чистом виде с помощью электролиза невозможно. #.
На практике применяют следующее: Термическое разложение. La2(C2O4)3 ® (t) ® La2O3$ + 3CO2 + 3CO
La2(CO3)3 ® (t) ® La2O3$ + 3CO2#. Металлотермия. La2O3 + 3Mg ® (t > tпл) ® 2La + 3MgO. Электролиз расплавов галогенидом. LaCl3 ® (электролиз, t» 850c) ® La$ (на катоде) + (3/2)Cl2# (на аноде).
Актиноиды
Особенности. Электронное строение: Э [ ] 5f1-14 [ ] 6d17s2. Наиболее тяжелые элементы следуют за актинием. Все элементы претерпевают радиоактивный распад. E (5f)» E(6d), близко к ядру Þ степени окисления Î [+3, +7]. Th (+4), Pa (+5), U (+6), Np (+6), Pu (+7), Am (+6), Cm (+4). Актиноидное сжатие.
Свойства тория.
Th [ ] 5f1 [ ] 6d17s2, +3, аналог R Th [ ] 5f0 [ ] 6d27s2, +4, аналог 4d: Zr, Hf. Th + O2 ® ThO2. Взрыв. Получение: Th3(PO4)4$ + 12NaOH ® (t) ® 3Th(OH)4 + 4Na3PO4. Свойства соединений тория Th+4. Th(NO3)4 + 4NaOH " Th(OH)4¯ + 4NaNO3. Th(OH)4 + NaOH ¹. Th(OH)4¯ + 4HCl ® ThCl4 + 4H2O. Th(NO3)4 + 2Na2CO3 + H2O ® ThOCO3¯ + 4NANO3 + H2O + CO2. ThOCO3 + 3Na2CO3 + H2O ® Na4[Th(CO3)4] + 2NaOH. КЧ=8. Th(NO3)4 + 2(NH4)C2O4 ® Th(C2O4)2¯ + 4NH4NO3. Th(C2O4)2¯ + 2(NH4)C2O4 ® (NH4)4[Th(C2O4)4] КЧ=8. ThF4¯ + 4Na2CO3 ® Na4[Th(CO3)4] + 4NaF. Th(NO3)4 + K4[Fe(CN)6] ® Th[Fe(CN)6]¯ + 4KNO3. Th[Fe(CN)6]¯ + 4Na2CO3 ® Na4[Th(CO3)4] + Na4[Fe(CN)6]. Качественные реакции на Th + 4. Th(NO3)4 + HCl + ”торон”® соединение малинового цвета. H2O + HCl + ”торон”® соединение оранжевого цвета. Отделение тория. От Ce3+ и R3+. Кислотно-основное: R(OH)3$ + 3HCl ® (pH = 6,5) ® RCl3 + 3H2O. Th(OH)4$ + 4HCl ® (pH = 3) ® ThCl4 + 4H2O. 2Ce(OH)3$ + 8HCl ® (pH = 1) ® 2CeCl3 + Cl2 + H2O. Комплексообразование (Th4+ — мощный комплексообразователь): ThCl4 + (NH4)2C2O4 ® (NH4)4[Th[C2O4)4] + 4NH4Cl RCl3 + 3(NH4)2C2O4 ® R2(C2O4)3$ + 3NH4Cl. От (U+6O2)2+, Th4+. На образовании труднорастворимых фторидов: ThCl4 + 4KF ® ThF4$ + 4KCl
UO2Cl2 + KF ® UO2F2 (раствор) + KCl На комплексообразовании: ThCl4 + 4(NH4)2C2O4 ® NH4)4[Th4+(C2O4)4]4- + 4NH4Cl. 2RCl3 + Na2C2O4 ® R2(C2O4)$ + NaCl. От U+6: ThCl4 + 4KF ® ThF4$ + 4KCl. UO2Cl2 + 2KF ® UO2F2 (раствор) ® 2KCl. Получение тория. Th(C2O4)2 ® (t) ® ThO2$ + 2CO# + 2CO2#. Металлотермия: ThO2 + Ca ® (t) ® Th$ + CaO. Без воды. Иначе взрыв. Электролиз расплава: K2[ThF6] (KCl, NaCl) ® Th$ (порошкообразный) + Cl2#. Иодидное рафинирование (газотранспортные реакции): ThI4 D Th + 2I2. ThO2/Th3N4/ThC+I2 не идёт. 1 зона: Th + I2 ® (t) ® ThI4 (газ) ® во вторую зону. 2 зона: ThI4 ® (t) ® Th$ (чистый) + 2I2.
Свойства урана.
U [ ] 5f3 [ ] 6d17s2, +3 (малоустойчив, аналог R3+) U [ ] 5f2 [ ] 6d27s2, +4 (уст, аналог Th, Ti, Zr. Hf) U [ ] 5f1 [ ] 6d37s2, +5 (неустойчив) U [ ] 5f0 [ ] 6d47s2, +6, (аналог Cr+6, Mo+6, W+6, [S+6]). Свойства металлического урана. Активен! j (U+4/U) = -1,2 V. a — распад. tполураспада = 4*109, tплавл = 1100с. U + O2 ® UO2; 2U + 3O2 ® 2UO2; 3U + 4O2 ® U3O8 – защитная плёнка. 2U + N2 ® 2UN; U + 2C ® UC2; U + 3Cl ® UCl6; U + 3F2 ® UF6. UCl6 и UF6 — летучие газообразные. Химические свойства урана. U+3 (аналог R3+) D U+4 (аналог Th4+) D U+6. Свойства U+6. U+6 амфотерен и в растворе не присутствует никогда. Пример амфотерности: 5U(SO4)2 + 2KMnO4 + 2H2O ® (pH < 7) ® 5UO2SO4 + 2MnSo4 + K2SO4 + 2H2SO4. 2U(SO4)2 + Zn (восст) ® U2(SO4)3 + ZnSO4 Качественная реакция на U4+. U(SO4)2 + KF ® UF4$ + K2SO4 U(SO4)2 + K4[Fe(CN)6] ® U[Fe(CN)6]. Гидролиз солей U+6. U+6 + H2O D U(OH)4+2 + 4H+, pH < 7. UO2(OH2) (основание) D H2UO4 (кислота). U+6 амфотерен. Примеры: Взаимодействие с кислотами: UO2(OH)2 + H2"O4 ® UO2"O4 + H2O. Взаимодействие с основаниями: 2UO2(OH)2 + 2NaOH ® Na2U2O7$ + 2H2O. Растворимость. Растворимы: UO2SO4, UO2Cl2, UO2(NO3)2. Нерастворимы: UO2(OH)2, MeU2O7 (Me: NH4+, Na+), UO2HPO4. Качественная реакция на U4+. U(SO4)2 + KF ® UF4$ + K2SO4 UO2SO4 + K4[Fe(CN)6] ® (UO2)[Fe(CN)6] (тёмно-коричневый)+ 2K2SO4. (UO2)2[Fe(CN)] + 6NaOH ® Na2U2O7$ + Na4[Fe(CN)6]. Качественные реакция на ион диоксоурана UO22+. 2UO2(NO3)2 + K4[Fe(CN)6] ® (UO2)2[Fe(CN)6]¯(кор) + 4KNO3 (UO2)2[Fe(CN)6]¯ + 6Na(OH)(изб) ® Na2U2O7¯жёлт + Na4[Fe(CN)6] + 3H2O. Комплексообразование. Na2U2O$ + 6NaCO3 + 3H2O ® 2Na4[UO2{CO3)3]. UO2SO4 (окислитель) + Zn + 2H2SO4 ® U(SO4)2 + ZnSO4 + 2H2O. Очистка урана. (примеси — Ra) U3O8 + MnO2 + 4H2SO ® 3UO2SO4 (раствор + примеси) + MnSO4 + 4H2O. 1) Ra2+ + H2SO4 ® RaSO4$ + 2H+. Очистка от активных примесей. 2) UO2SO4 + 3Na2CO3 ® Na4[UO2(CO3)32-] + Na2SO4. Карбонатная очистка. Очистка урана от тория: 1 ст). Сорбция на твёрдом катиониде. Th4+ + 4RHSO3 ® Th(RSO3)$ + 4H+. UO22+ + 2RHSO3 ® UO2(RSO3)2$ + 2H+. 2 ст) Десорбция. В качестве десорбента используют раствор кислоты HCl разной концентрации, который подбирается так, чтобы десорбция катионов происходила селективно (только по одному катиону). См. рис. Получение урана. Na4[UO2(CO3)3 + 3H2SO4 ® UO2SO4 + 3U2CO3 + 2Na2SO4 Осаждение) UO2SO4 + 2NaOH (мало) ® UO2(OH)2$ + 2Na2SO4 Термическое разложение) UO2(OH)2 ® (t) ® UO3 + H2O# Восстановление) U+6O3 + H2 ® U+4O2 + H2O Синтез фторида) UO2 + HF ® (t = 600c) ® UF4 + 2H2O Металлотермия) UF4 + Ca ® (t > Tпл) ® U$(плавл) + CaF2.
Свойства соединений урана U+6.
UO2(NO3)2+2NaOH(мало)®UO2(OH)2¯+2NaNO3. UO2(OH)2¯+2NaOH(изб)®Na2U2O7¯+3H2O. Na2U2O7¯+6Na2CO3+3H2O®2Na4[UO2(CO3)3]+6NaOH. КЧ=6; UO2SO4+Zn+2H2SO4®U(SO4)2+ZnO4+2H2O
UO2SO4+NaF«UO2F2+Na2SO4. U(SO4)2+4NaF®UF4¯+2Na2SO4. 2UO2SO4+K4[Fe(CN)6]®(UO2)2[Fe(CN)6]¯+2K2SO4. U(SO4)2+K4[Fe(CN)6]®U[Fe(CN)6]¯ +2K2SO4.
Разделение элементов
Классификация методов разделения. По целевому назначению: Методы грубого (предварительного) разделения Получение чистых и особо чистых веществ Химические методы защиты окружающей среды от вредных примесей. По целевому назначению?: Химические Физико-химические Физические Химические методы разделения и очистки веществ. Методы используют различия в константах скорости реакций. Осаждение. Метод основан на различной растворимости компонентов раствора. Процесс осаждения зависит от состава водной фазы, pH – среды, температуры, последовательности смешивания растворов. В некоторых случаях процесс осаждения осложняется образованием коллоидных растворов или осаждением примеси с основными элементами. Требования к реакциям осаждения: Образование стехиометрически определённых соединений. Проведение реакций лишь в тех условиях, когда отсутствует соосаждение и образование коллоидных систем. Лёгкость доведения осадка для обеззараживания промышленных стоков и очистки их от примесей тяжёлых элементов. При значениях pH Î [4, 7] практически все тяжёлые металлы образуют труднорастворимые гидроксиды. Осаждение гидроксидов различных металлов. Чем сильнее гидроксид, тем выше pH. При pH>7 Отделение металлов за счёт способности образовывать осадки. Sc от трёхвалентных РЗ эл-тов Sc3+(NO3)3 + 3KF ® ScF3$ + 3KNO3 R3+(NO3)3 + 3KF ® RF3$ + KNO3 ScF3 + 3KF ® K3[ScF6] RF3 + KF не идёт. Цементация — выделение металла из растворов их солей более активными металлами Электродный потенциал металла должен быть больше, чем ЭП выделяемого металла. CdSO4 + Zn ® Cd$ + ZnSO4. CuSO4 + Fe ® Cu$ + FeSO4. 2EuCl3 + Zn + 3H2SO4 ® 2Eu$ + ZnSO4 + 6HCl 3MnSO4 + 2KMnO4 + 2H2O ® 5MnO2$ + K2SO4 + 2H2SO4. CeCl3 + KMNO4 + *NaOH + 2H2O ® Ce(OH)4$ + MnO2 + KCl + 8NaCl Ag+ + Cl- ® AgCl$; K+ + ClO4- ® KClO4; Ba2+ + SO4- ® BaSO4. Реакции растворения: Th4+ + C2O4 ® [Th(C2O4)4]4- (раствор) La+3 + C2O42- ® La2(C2O4)3$.26
Физические методы разделения
Кристаллизация, зонная плавка, термодиффузия, ретификация. Кристаллизация — процесс образования и роста кристалла из раствора, расплава или газа. Происходит с разной скоростью за счёт создания еравновесных условий (перенасыщение или переохлаждение раствора). Отделение Zr и Hf. ногоступенчатая фракционная кристаллизация основана на растворении солей Zr и Hf (у K2[HfF4] растворимость в 2–4 раза выше, чем у K2[ZnF6]. Зонная плавка — бестигельная кристаллизация. Единственный однофазный метод. Термодиффузия — стеклянная трубка, один конец которой нагрет, другой охлаждён. Разность концентраций газообразных веществ создаётся за счёт различия коэффициента диффузии в температурном поле. Используется для разделения изотопов урана в виде летучего UF6. Дистилляция (перегонка). Разделение жидких смесей, основанное на различии состава жидкости и состава равновесного с ней пара.
Химические транспортные реакции
В основе метода лежат обратимые гетерогенные реакции, сопровождающиеся переносом очищаемого вещества из одной температурной зоны (T1) в другую (T2) с более высокой температурой. в результате образования и разложения газообразных промежуточных соединений. Широко применяются газообразные иодиды металлов. Иодидное рафинирование: Meтв + (n/2)I2 D MeIn(г). Основные стадии транспортных реакций: 1) Образование летучего продукта из твёрдого металла и газообразного реагента в низкотемпературной зоне. Zr + 2I2 ® ZrI4 (г) 2) Транспорт летучего соединения из зоны T1 в зону T2. 3) Разложение летучего соединения на чистый металл и газообразный реагент, который возвращается в зону T1: ZrI4 (г) ® (T2) ® Zr$ (чистый) + I2. Достоинство метода: возможность глубокой очистки от O2, N2, H2, C2, т. к. в аналогичных условиях иод не реагирует с оксидам, нитридами, карбидами, гидридами и пр. Экстракция — процесс извлечения вещества из одной жидкой фазы в другую. Как правило, одна фаза — вода, другая — органическая. В основе метода лежит закон распределения вещества между двумя несмешивающимися жидкостями. ТД константа распределения K = aa(орг) / aa(неорг) = сa(орг) / ca(орг) = D. В случае, когда коэффициент активности можно заменить концентрацией (растворы электролитов/предельно разбавленные растворы), в системе выполняется предельный закон Бертло-Нернста. Закон: растворённое вещество распределяется между двумя несмешивающимися жидкостями таким образом, что отношение равновесных концентраций вещества A в обеих фазах не зависит от общей концентрации растворённого вещества при условии, что в каждой фазе вещество имеет одну и ту же молекулярную массу. В случае диссоциации (ассоциации) в растворах выражение закона усложняется. В экстракции может происходить процесс комплексообразования. ТБФ (трибутилфосфат) + [UO2(H2O)6]2+(NO3)2 ® [UO22+ (ТБФ)2 (NO3)-2]- + 6H2O.
Разделение редкоземельных элементов
Скандий. Отделение от других трёхвалентных элементов основано на том, что Sc способен образовывать комплекс с ионом F-. ScF3$ + 3KF ® K3[ScF6]3- (раствор). (La/Y)F3 + KF3 ¹. Церий. В основе отделения церия от других РЗЭ — способность обладать степенью окисления +4: Ce(OH)4$ + HCl ® (pH» 1,5) ® 2CeCl3 + Cl2# + 8H2O. Ce(OH)3$ + HCl ® CeCl3 + 3H2O. R(OH)3$ + HCl ® (pH = 6,5) ® RCl3 + 3H2O. Комплексообразование — один из способов отделения: церий, в отличие от других редкоземельных элементов, в степени окисления +3 способен образовывать комплексы с КЧ = 8 (растворы солей: оксолатов и карбонатов): Ce(C2O4)2$ + (NH4)C2O4 ® (NH4)[Ce+4(C2O4)]4-. Na2/R2/Ce2(C2O4)3$ + (NH4)C2O4 ¹. Европий. Отделение от других РЗЭ связано с его способностью образовывать труднорастворимый сульфат в двухвалентном состоянии: R2(SO4)3 — раствор. Eu2(SO4)3 + Zn (" восстановитель) ® (pH < 7) ® 2EuSO4$ + ZnSO4. Eu(OH)2 + H2SO4 " EuSO4 + 2H2O. R2SO4 растворим. Торий. От Ce3+ и R3+ (РЗ): Кислотно-основное: Th(OH)4$ + 4HCl ® (pH = 3) ® ThCl4 + 4H2O. R(OH)3$ + 3HCl ® (pH = 6,5) ® RCl3 + 3H2O. 2Ce(OH)3$ + 8HCl ® (pH = 1) ® 2CeCl3 + Cl2 + H2O. Комплексообразование (Th4+ — мощный комплексообразователь): ThCl4 + (NH4)2C2O4 ® (NH4)4[Th[C2O4)4] + 4NH4Cl RCl3 + 3(NH4)2C2O4 ® R2(C2O4)3$ + 3NH4Cl. От (UO2)2+: На образовании труднорастворимых фторидов: ThCl4 + 4KF ® ThF4$ + 4KCl UO2Cl2 + KF ® UO2F2 (раствор) + KCl. На комплексообразовании: ThCl4 + 4(NH4)2C2O4 ® (NH4)4[Th4+(C2O4)4]4- + 4NH4Cl. 2RCl3 + Na2C2O4 ® R2(C2O4)$ + NaCl. От U+6: ThCl4 + 4KF ® ThF4$ + 4KCl. UO2Cl2 + 2KF ® UO2F2 (раствор) ® 2KCl. Уран. UO2SO4 + 3Na2CO3 " Na4[UO2(CO3)3] + Na2SO4. Fe2(SO4) + 3Na2CO + 6H2O " 2Fe(OH)3$ + 3H2CO3 + 3NaSO4. 2RCl3 + 3Na2CO3 " R2(CO3)3$ + 6NaCl.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 963; Нарушение авторских прав?; Мы поможем в написании вашей работы!